
 向100mLNaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入1mol/L的盐酸,产生CO2的体积与所加稀盐酸体积之间关系如图所示.
向100mLNaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入1mol/L的盐酸,产生CO2的体积与所加稀盐酸体积之间关系如图所示.分析 过程中发生的反应:2NaOH+CO2═Na2CO3+H2O、NaOH+HCl═NaCl+H2O、Na2CO3+HCl═NaCl+NaHCO3、NaHCO3+HCl═NaCl+CO2↑+H2O,由图可知0-25ml是碳酸钠与盐酸反应,而25-100ml是盐酸与碳酸氢钠反应,当100ml时是单一溶质NaCl,根据组成,则n(HCl)=n(NaCl),由此分析解答.
解答 解:过程中发生的反应:2NaOH+CO2═Na2CO3+H2O、NaOH+HCl═NaCl+H2O、Na2CO3+HCl═NaCl+NaHCO3、NaHCO3+HCl═NaCl+CO2↑+H2O,由图可知0-25ml是碳酸钠与盐酸反应,而25-100ml是盐酸与碳酸氢钠反应,当100ml时是单一溶质NaCl,
(1)原NaOH溶液的物质的量浓度为$\frac{100×1{0}^{-3}×1}{0.1}$=1mol/L,故答案为:1;
(2)NaHCO3+HCl═NaCl+CO2↑+H2O
1mol 22.4L
(100-25)×10-3×1 V
所以:V=$\frac{22.4L×(100-25)×1{0}^{-3}}{1}$=1680ml,故答案为:1680;
(3)通入CO2后所得溶液的溶质成分为碳酸钠和碳酸氢钠,物质的量之比为:25:(100-25-25)=1:2,所以n(Na2CO3)=0.025mol,n(NaHCO3)=0.05mol,所以质量为:0.025mol×106g/mol+0.05mol×84g/mol=6.85g,故答案为:碳酸钠和碳酸氢钠;6.85g.
点评 本题考查化学反应的计算,题目难度较大,把握图象分析与各阶段发生的化学反应的对应关系为解答的关键,侧重分析能力和计算能力的考查.


 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:选择题
| 操作及现象 | ||
| A | 某溶液中加入盐酸,产生能使澄清石灰水变浑浊的无色无味气体 | 溶液中一定含有CO32- |
| B | 将砂纸打磨过的铝箔置于酒精灯外焰上灼烧,熔化的铝以小液滴的形式滴落下来 | Al的熔点低,加热时Al熔化 |
| C | 用洁净铂丝蘸取某溶液在火焰上灼烧,火焰呈黄色 | 溶液中有Na+,无Κ+ |
| D | 向某溶液中先加几滴KSCN溶液,无明显现象,再滴加氯水,溶液变红 | 溶液中一定含有Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
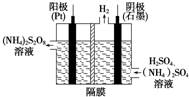 (1)过二硫酸铵法(如图所示)是目前最流行的制备H2O2的方法.即电解含H2SO4、(NH4)2SO4的溶液制取(NH4)2S2O8,再与热水反应即可得H2O2和(NH4)2SO4.
(1)过二硫酸铵法(如图所示)是目前最流行的制备H2O2的方法.即电解含H2SO4、(NH4)2SO4的溶液制取(NH4)2S2O8,再与热水反应即可得H2O2和(NH4)2SO4.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4:1 | B. | 1:4 | C. | 1:6 | D. | 6:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
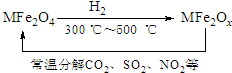 新型纳米材料氧缺位铁酸盐MFe2Ox(3<x<4,M=Mn、Zn、Ni,且均为+2价,下同)是由铁酸盐MFe2O4经过高温与H2反应制得.常温下,它能使工业废气中的酸性氧化物(SO2、NO2等)转化为其单质除去,转化流程如图:
新型纳米材料氧缺位铁酸盐MFe2Ox(3<x<4,M=Mn、Zn、Ni,且均为+2价,下同)是由铁酸盐MFe2O4经过高温与H2反应制得.常温下,它能使工业废气中的酸性氧化物(SO2、NO2等)转化为其单质除去,转化流程如图:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 目的 | 操作 |
| A | 配置100mL 1.0mol•L-1CuSO4溶液 | 将25gCuSO4•5H2O溶于100mL蒸馏水中 |
| B | 除去KNO3固体中少量NaCl | 将混合物制成熟的饱和溶液,冷却结晶,过滤 |
| C | 提取溴水中的Br2 | 向溶液中加入乙醇后振荡,静置,分液 |
| D | 检验溶液中是否含有NH4+ | 取少量溶液于试管中,加入NaOH后,加热,在试管口放置 一块湿润的红色石蕊试纸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在滴加酸碱指示剂酚酞试液后呈现红色的溶液中:Na+、Cl-、AlO2-、CO32- | |
| B. | 在由水电离出的c(H+)=1×10-12mol/L的溶液中:HCO3-、Al3+、NH4+、ClO- | |
| C. | 在$\frac{c({H}^{+})}{c(0{H}^{-})}$=1×1012的溶液中:Fe2+、Mg2+、CO32-、NO3- | |
| D. | 在AlCl3溶液中:K+、NO3-、S2-、Na+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com