
【题目】8.8g FeS与400mL 1 mol/L硝酸溶液恰好完全反应,反应后产物为Fe2(SO4)3和Fe(NO3)3, X、H2O,则X为( )
A.N2B.NOC.N2OD.NO2
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是
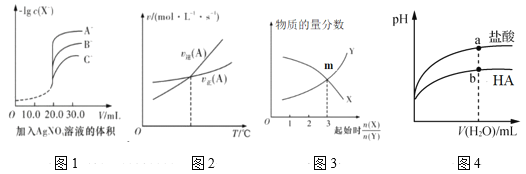
A.用硝酸银溶液滴定等浓度的A-、B-、C-的混合溶液(均与Ag+反应生成沉淀),由图1可确定首先沉淀的是C-
B.图2表示反应中某反应物的正、逆反应速率随温度变化的情况, 由图可知该反应的正反应是吸热反应
C.图3表示一定条件下,X(g)![]() Y(g)+Z(s)中物质的量分数随起始投料比变化。m点对应的X转化率为33.3%
Y(g)+Z(s)中物质的量分数随起始投料比变化。m点对应的X转化率为33.3%
D.图4表示常温下稀释pH相同的HA与盐酸时溶液pH与加入水体积的关系,则HA为弱酸,且a点Kw的数值比b点的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,所使用的装置(部分夹持装置略)、试剂和操作方法都正确的是 ( )
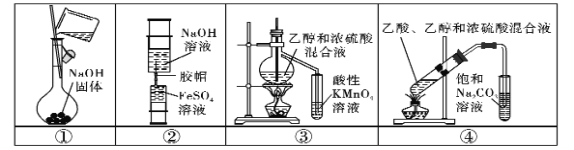
A.用装置①配制250 mL0.1 mol.L-1的NaOH溶液
B.用装置②制备少量Fe(OH)2固体
C.用装置③验证乙烯的生成
D.用装置④制取少量乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:

已知:
①2KOH+Cl2===KCl+KClO+H2O(条件:温度较低)
②6KOH+3Cl2===5KCl+KClO3+3H2O(条件:温度较高)
③2Fe(NO3)3+3KClO+10KOH===2K2FeO4+6KNO3+3KCl+5H2O
回答下列问题:
(1)该生产工艺应在______________(填“温度较高”或“温度较低”)情况下进行,从绿色化学的角度考虑通入氯气速率应________(填“较快”或“较慢”);
(2)写出工业上制取Cl2的化学方程式_____________;
(3)为了提高生活用水的卫生标准,自来水厂常使用高铁酸钾(K2FeO4)进行消毒、净化以改善水质,其原因是______
(4)配制KOH溶液时,是在每100mL水中溶解61.6g KOH固体(该溶液的密度为1.47 g/mL),它的物质的量浓度为____________(保留整数);
(5)在“反应液I”中加KOH固体的目的是__________:
A.与“反应液I”中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供反应物
D.使副产物KClO3转化为 KClO
(6)该工艺每得到1.98 kg K2FeO4,理论上消耗Cl2的物质的量为___________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭真空容器中加入一定量纯净的氨基甲酸铵固体(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s) ![]() 2NH3(g)+CO2(g) ΔH>0。下列说法中正确的是( )
2NH3(g)+CO2(g) ΔH>0。下列说法中正确的是( )
A.密闭容器中气体的平均相对分子质量不变,则该反应达到平衡状态
B.密闭容器中气体的密度不变,则该反应达到平衡状态
C.再加入一定量氨基甲酸铵,可加快正反应速率
D.保持温度不变,压缩体积,可使正、逆反应速率都增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水的综合利用一直是研究课题。某地天然海水(主要含Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO3-等离子),研究用海水吸收燃煤排放的含有SO2烟气的工艺流程如图所示,下列说法中正确的是
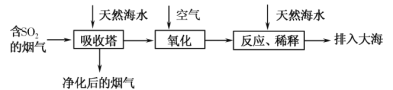
A.工艺中天然海水显酸性
B.氧化过程中可能发生的离子反应为2SO2+2H2O+O2=4H++2SO42-
C.排入大海的溶液与天然海水相比,只有SO42-数量发生了变化
D.若将氧化后的液体进行蒸发结晶,得到的晶体中CaSO4含量最高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O]是分析化学中重要的试剂,常用于代替硫酸亚铁。硫酸亚铁铵晶体在500℃时隔绝空气加热完全分解。回答下列问题:
(1)硫酸亚铁铵晶体隔绝空气加热完全分解发生了氧化还原反应,固体产物可能有FeO和Fe2O3 ,气体产物可能有NH3、SO3、H2O、N2和__________。
(2)为检验分解产物的成分,设计如下实验装置进行实验,加热A中的硫酸亚铁铵晶体至分解完全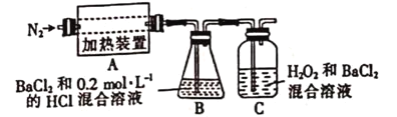
为检验A中残留物是否含有FeO,需要选用的试剂有____________(填标号)。
A.KSCN溶液 B.稀硫酸 C.浓盐酸 D.KMnO4溶液
(3)装置C中有不溶于酸的白色沉淀生成,则C中发生的化学反应的方程式为:____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】给定条件下,下列选项中所示的物质间在相应条件下转化均能一步实现的是( )
A.SiO2![]() H2SiO3
H2SiO3![]() Na2SiO3(aq)
Na2SiO3(aq)
B.Ca(OH)2![]() Ca(ClO)2
Ca(ClO)2![]() HClO
HClO
C.MgCl26H2O![]() MgCl2
MgCl2![]() Mg
Mg
D.N2![]() NO2
NO2 ![]() HNO3
HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在杠杆的两端分别挂着质量相同的铝球和铁球,此时杠杆平衡。然后将两球分别浸没在溶液质量相等的稀烧碱溶液和硫酸铜溶液中一段时间,如图所示。下列说法正确的是( )
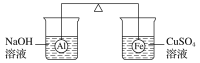
A.铝球表面有气泡产生,且有白色沉淀生成,杠杆不平衡
B.铝球表面有气泡产生,溶液澄清;铁球表面有红色物质析出,杠杆右边下沉
C.反应后去掉两烧杯,杠杆仍平衡
D.右边球上出现红色,左边溶液的c(OH-)增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com