
【题目】开发清洁能源是当今化工研究的一个热点问题。二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用,工业上以CO和H2为原料生产CH3OCH3。工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
①CO(g)+2H2(g)CH3OH(g) ΔH1=-99kJ·mol1
②2CH3OH(g)CH3OCH3(g)+H2O(g) ΔH2=-23.5kJ·mol1
③CO(g)+H2O(g)CO2(g)+H2(g) ΔH3=-41.2kJ·mol1
(1)催化反应室中的总反应3CO(g)+3H2(g)CH3OCH3(g)+CO2(g),计算ΔH=_______。反应来自煤的气化。已知该反应的平衡常数表达式为K=![]() ,每生成1mol H2需要吸收131.3kJ的热量。写出该反应的热化学方程式____________。
,每生成1mol H2需要吸收131.3kJ的热量。写出该反应的热化学方程式____________。
(2)在该条件下,若反应①的起始浓度分别为:c(CO)=0.6mol·L1,c(H2)=1.4mol·L1,8min后达到平衡,CO的转化率为50%,则8min内H2的平均反应速率为__________。
(3)在t℃时,反应②的平衡常数为400,此温度下,在1L的密闭容器中加入一定的甲醇,反应到某时刻测得各组分的物质的量浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
c(mol·L1) | 0.46 | 1.0 | 1.0 |
此时刻v正___v逆(填“>”“<”或“=”),平衡时c(CH3OCH3)的物质的量浓度是___。
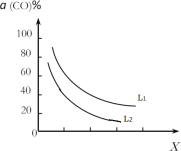
(4)在(1)小题中催化反应室的总反应3CO(g)+3H2(g)CH3OCH3(g)+CO2(g),CO的平衡转化率a(CO)与温度、压强的关系如图所示,图中X代表___(填“温度”或“压强”),且L1___L2(填“>”“<”或“=”)。
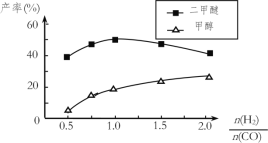
(5)在催化剂的作用下同时进行三个反应,发现随着起始投料比![]() 的改变,二甲醚和甲醇的产率(产物中的碳原子占起始CO中碳原子的百分率)呈现如图的变化趋势。试解释投料比大于1.0之后二甲醚产率和甲醇产率变化的原因:_____。
的改变,二甲醚和甲醇的产率(产物中的碳原子占起始CO中碳原子的百分率)呈现如图的变化趋势。试解释投料比大于1.0之后二甲醚产率和甲醇产率变化的原因:_____。
【答案】-262.7kJ·mol1 C(s)+H2O(g)H2(g)+CO(g)ΔH=+131.3kJ·mol1 0.075mol·L1·min1 > 1.2mol·L1 温度 > 当投料比大于1时,随着c(H2)增大,反应①被促进,而反应③被抑制,c(H2O)增大,最终抑制反应②,因此甲醇的产率继续增大而二甲醚的产率减小
【解析】
(1)催化反应室中的总反应3CO(g)+3H2(g)CH3OCH3(g)+CO2(g),根据盖斯定理可按以下方法联立得到:①×2+②+③,该反应ΔH=-99kJ·mol1×2+(-23.5kJ·mol1)+(-41.2kJ·mol1)= -262.7kJ·mol1;根据煤的气化平衡常数表达式以及质量守恒,可写出该反应的化学方程式为:H2O(g)+C(s)H2(g)+CO(g),根据生成1mol H2需要吸收131.3kJ的热量可知该反应的ΔH=+131.3kJmol1,则该反应的热化学方程式为:C(s)+H2O(g)H2(g)+CO(g) ΔH=+131.3kJ·mol1;
(2)根据题给数据,CO的反应量为0.6mol/L×50%=0.3mol/L,H2的反应量为0.6mol/L,则8min内H2的平均反应速率为:v(H2)=![]() =0.075molL1min1;
=0.075molL1min1;
(3)该时刻反应的浓度熵为:Qc=![]() <400,反应正向进行,所以,v正>v逆;设从该时刻至达到平衡时CH3OCH3物质的量浓度变化量为x,则有:
<400,反应正向进行,所以,v正>v逆;设从该时刻至达到平衡时CH3OCH3物质的量浓度变化量为x,则有:
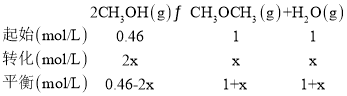
![]() ,解得x=0.2,则平衡时c(CH3OCH3)=1mol/L+0.2mol/L=1.2mol/L;
,解得x=0.2,则平衡时c(CH3OCH3)=1mol/L+0.2mol/L=1.2mol/L;
(4)根据催化反应室的总反应放热,化学方程式3CO(g)+3H2(g)CH3OCH3(g)+CO2(g) ΔH=-262.7kJ·mol1可知,正向反应气体减少,反应放热,所以CO的平衡转化率α(CO)随温度的升高而减小、随压强的增大而增大,图中曲线随X增大而减小,可判断X是温度,则L1、L2是压强,且L1>L2;
(5)结合图象,根据平衡移动原理随着![]() 增大,反应①CO转化率增大,甲醇的产率增大,进而有利于反应②正向移动;另一方面,随着
增大,反应①CO转化率增大,甲醇的产率增大,进而有利于反应②正向移动;另一方面,随着![]() 增大,反应③被抑制,c(H2O)增大,进而抑制了反应②;图中二甲醚产率随着
增大,反应③被抑制,c(H2O)增大,进而抑制了反应②;图中二甲醚产率随着![]() 增大先增大后减小的原因就是这两种因素共同作用的结果,题给图中投料比大于1.0之后二甲醚产率和甲醇产率变化的原因可释为:当投料比大于1时,随着c(H2)增大,反应①被促进,而反应③被抑制,c(H2O)增大,最终抑制反应②,因此甲醇的产率继续增大而二甲醚的产率减小。
增大先增大后减小的原因就是这两种因素共同作用的结果,题给图中投料比大于1.0之后二甲醚产率和甲醇产率变化的原因可释为:当投料比大于1时,随着c(H2)增大,反应①被促进,而反应③被抑制,c(H2O)增大,最终抑制反应②,因此甲醇的产率继续增大而二甲醚的产率减小。


科目:高中化学 来源: 题型:
【题目】在25°C时,某二元酸H2X及其钠盐的溶液中,H2X、HX-、 X2-分别在三者中所占的物质的量分数(Φ)随溶液pH变化关系如下图所示,下列叙述不正确的是( )
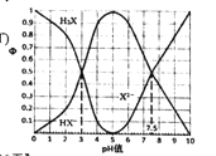
A.在pH=5 的溶液中,存在 =10-4.5
=10-4.5
B.在pH=7.5的溶液中,存在3c(HX-)=c(Na+)+c(H+)-c(OH-)
C.将相同物质的量的Na2X和NaHX完全溶于水所得溶中液的pH值为7.5
D.等体积等浓度的NaOH溶液与H2X溶液混合,溶液显酸性且存在c(H+)+(H2X)=c(OH-)+c(X2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,用0.1 mol·L-1 NaOH溶液滴定20 mL 0.1 mol·L-1 HX溶液,溶液的pH随加入的NaOH溶液体积的变化如图所示。下列说法不正确的是( )
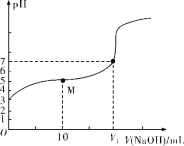
A.HX为弱酸
B.V1<20
C.M点溶液中离子浓度由大到小的顺序:c(X-)>c(Na+)>c(H+)>c(OH-)
D.0.1 mol·L-1 NaOH溶液和0.1 mol·L-1 HX溶液等体积混合后,溶液中c(Na+)=c(X-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙酮常温下为无色晶体或浅黄色油状液体,是山楂、含羞草、紫丁香等香精的调合原料,并广泛用于皂用香精和烟草香精中,可由苯经下述反应制备:
![]() +(CH3CO)2O
+(CH3CO)2O![]()
![]() +CH3COOH
+CH3COOH
NA代表阿伏加德罗常数的值。下列有关说法正确的是
A.气态苯乙酮的密度是气态乙酸密度的2倍
B.1mol苯所含的化学单键数目为12 NA
C.0.5mol乙酸酐中含有的电子数目为27 NA
D.1L2mol/LCH3COOH溶液与足量钠反应生成的气体分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,分别向体积相同、浓度均为1 mol/L的HA、HB两种酸溶液中不断加水稀释,酸溶液的pH与酸溶液浓度的对数(lg C)间的关系如图。下列对该过程相关分析正确的是
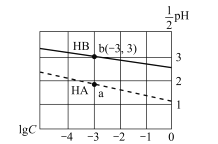
A. HB的电离常数(KA)数量级为10-3
B. 其钠盐的水解常数(Kh)大小关系是:NaB>NaA
C. a、b两点溶液中,水的电离程度b<a
D. 当lg C= -7时,两种酸溶液均有pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家利用回旋加速器进行实验,成功制成115号元素的原子。该原子在生成数秒后衰变成113号元素,115号元素的一种核素为![]() 。下列有关叙述中正确的是
。下列有关叙述中正确的是
A.核素![]() 的中子数为174B.115号与113号元素互为同位素
的中子数为174B.115号与113号元素互为同位素
C.113号元素的原子的质量数为113D.115号元素衰变成113号元素是化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如右图所示.则下列离子组在对应的溶液中一定能大量共存的是

A. a点对应的溶液中:Na+、OH-、SO42-、NO3-
B. b点对应的溶液中:Al3+、Fe3+、NO3-、Cl-
C. c点对应的溶液中:Na+、Ca2+、NO3-、Cl-
D. d点对应的溶液中:Cl-、NO3-、Fe2+、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.10 molL-1NH3H2O标准溶液滴定20 mL0.10 molL-1盐酸与未知浓度CH3COOH的混合溶液,混合溶液的相对导电能力变化曲线如图所示,已知Kb(NH3·H2O) =Ka(CH3COOH)。下列叙述错误的是
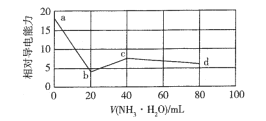
A.H+的导电能力大于等浓度的NH4+
B.a点混合溶液中c( CH3COO- ) +c( CH3COOH) =0.10 molL-1
C.b点混合溶液中,c( NH4+ ) +c( NH3H2O) >c( CH3COOH)
D.c点混合溶液中,c(NH4+) >c(Cl-) >c(CH3COO-) >c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在酸性溶液中,碘酸钾(KIO3)和Na2SO3可发生如下反应:2![]() +5
+5![]() +2H+=I2+5
+2H+=I2+5![]() +H2O,生成的碘可以用淀粉溶液检验,根据溶液出现蓝色所需的时间来衡量该反应的速率。某学生设计实验如下表所示(表格中体积单位均为mL):
+H2O,生成的碘可以用淀粉溶液检验,根据溶液出现蓝色所需的时间来衡量该反应的速率。某学生设计实验如下表所示(表格中体积单位均为mL):
0.01mol/LKIO3溶液的体积 | 某浓度的Na2SO3溶液的体积 | H2O的体积 | 实验温度/℃ | 溶液出现蓝色所需时间 | |
实验1 | 5 | 5 | V1 | 0 | a |
实验2 | 5 | 5 | 20 | 25 | b |
实验3 | 5 | V2 | 15 | 25 | c |
(1)V1=______ mL,V2=______ mL。
(2)如果研究浓度对反应速率的影响,使用实验__________和实验__________。
(3)对比实验1和实验2,可以研究__________对化学反应速率的影响。
(4)溶液出现蓝色所需的时间从多到少的顺序是__________(用a、b、c表示)。
(5)已知反应:2Na2SO3(aq)+O2(aq)=2Na2SO4(aq)。在291.5K时,1.0 L溶液中Na2SO3初始量为10 mmol(1 mol=103 mmol),每5s记录一次溶解氧浓度,一段时间后实验结果如曲线,求0-40s内Na2SO
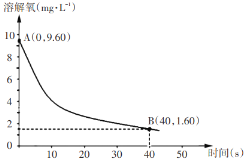
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com