
【题目】KClO3和KHSO3能发生反应:ClO3-+HSO3-→SO42-+ Cl-+ H+(未配平)。已知该反应的速率随c(H+)的增大而加快。下图为用ClO3-在单位时间内物质的量浓度变化表示的该反应υ-t图。下列说法不正确的( )

A.反应开始时速率增大可能是c(H+)所致
B.纵坐标为υ(Cl-)的υ-t曲线与图中曲线不能完全重合
C.后期速率υ下降的主要原因是反应物浓度减小引起的
D.图中阴影“面积”可以表示t1-t2时间内c(ClO3-)的减少量
【答案】B
【解析】
A.由方程式可知反应开始后随着反应的进行,c(H+)不断增大,由题目信息可知,反应开始时速率增大是c(H+)的增大所致,故A说法正确;;
B.生成物中Cl-是反应物ClO3-的还原产物,根据Cl守恒,故方程式中Cl-和ClO3-化学计量数之比为1:1,同一反应中反应速率之比等于化学计量数之比,所以v(Cl-)的v-t曲线与图中曲线应能完全重合,故B说法错误;
C. 随着反应的进行,反应物的浓度减少,反应速率减小,所以后期反应速率下降的主要原因是反应物浓度减小,故C说法正确;
D.该图像为v-t图像,![]() ,故
,故![]() ,故图中阴影“面积”可以表示t1-t2时间内c(ClO3-)的减少量,故D项说法正确;
,故图中阴影“面积”可以表示t1-t2时间内c(ClO3-)的减少量,故D项说法正确;
故答案为B。


科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列有关叙述不正确的是 ( )
A. 2.0 g D2O中含有的质子数、电子数均为NA
B. 室温下,7 g乙烯和丁烯的混合气体中所含的氢原子数目是NA
C. 室温下,2 L 0.05 mol·L-1 NH4NO3溶液中所含的氮原子数目是0.2NA
D. 256 g S8(分子结构如图 )含S—S键数目为7NA
)含S—S键数目为7NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向2L的密闭容器中投入一定量的X和Y,在催化剂的作用下发生反应:X(g) + Y(g)![]() Z(g)。反应过程中测定的部分数据如下表:
Z(g)。反应过程中测定的部分数据如下表:
t/min | n(X)/mol | n(Y)/mol |
0 | 1.20 | 0.60 |
1 | 0.90 | |
2 | 0.80 | |
4 | 0.20 |
下列说法正确的是
A. 反应1~2min末的平均速率v(Z)=0.2mol/(L·min)
B. 在2min~4min间,v(X)正>v(Y)逆
C. 生成1mol Z的同时,生成1mol X能说明该反应已达化学平衡状态
D. 其他条件不变,再充入1.2mol X,X的转化率将增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇(CH3OH)是一种绿色能源。如图所示,某同学设计一个甲醇燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜.

根据要求回答相关问题:
(1)写出负极的电极反应式__________________________________.
(2)铁电极为______(填“阳极”或“阴极” ),石墨电极(C)的电极反应式为______________.
(3)若在标准状况下,有2.24L氧气参加反应,丙装置中阴极析出铜的质量为______g。假设乙装置中溶液足量,若在标准状况下有448mL氧气参加反应,则乙装置中阳离子交换膜左侧溶液质量将增加_______g.
(4)若将乙装置中两电极位置互换,其他装置不变,此时乙装置中发生的总反应式________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
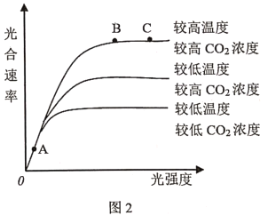
【题目】卡尔文循环过程如图1所示,探究各种环境因素对光合作用的综合影响结果如图2所示。请分析回答:
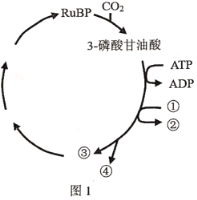
(1)图1过程在叶绿体的________中进行,RuBP的组成元素是________,![]() 和RuBP结合产生3-磷酸甘油酸的过程________(需要(不需要)消耗ATP。
和RuBP结合产生3-磷酸甘油酸的过程________(需要(不需要)消耗ATP。
(2)图1中的物质①可以为3-磷酸甘油酸的还原提供________,每生成1分子物质④需要经过________轮卡尔文循环,此时有________分子物质③用于RuBP的再生。
(3)图2中的自变量为________,限制A点光合速率的主要因素是________;若由A点条件变为B点条件,则短时间内3-磷酸甘油酸的生成速率________(增大/减小/基本不变);若由B点条件变为C点条件,则短时间内3-磷酸甘油酸的生成速率________(增大/减小基本不变)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为元素周期表中短周期的一部分,下列关于Y、Z、M的说法正确的是 ( )

A.电负性:![]()
B.离子半径:![]()
C.![]() 分子中各原子的最外层均满足8电子稳定结构
分子中各原子的最外层均满足8电子稳定结构
D.Z元素基态原子的最外层电子排布图为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素的离子![]() 、
、![]() 、
、![]() 、
、![]() 都具有相同的电子层结构,下列关系正确的是( )
都具有相同的电子层结构,下列关系正确的是( )
A.离子的还原性:![]() ,质子数:
,质子数:![]()
B.氢化物的稳定性:![]()
C.第一电离能:![]() ,原子半径:
,原子半径:![]()
D.电负性:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+B(g) ![]() 2C(g) ΔH<0,达到平衡时,下列说法正确的是
2C(g) ΔH<0,达到平衡时,下列说法正确的是
A. 加入催化剂,B的转化率增大 B. 减小容器体积,平衡不移动
C. 增大c(A),A的转化率增大 D. 降低温度,v正 增大,v逆 减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组欲探究氯气的化学性质,设计如图所示的实验装置。

已知:该装置气密性良好;铜粉放在耐高温托盘内(防止硬质玻璃管炸裂)。
请回答下列问题:
(1)为防止铜与空气中的氧气反应,在加热之前应该进行的操作为____。
(2)当观察到AgNO3溶液中出现白色沉淀时,点燃酒精灯加热;写出AgNO3溶液中发生反应的化学方程式:____。
(3)硬质玻璃管中的反应现象为____,反应的化学方程式为____。
(4)装置中空试管的作用是____。
(5)实验中,观察到紫色石蕊溶液颜色的变化为____。
(6)烧杯中氢氧化钠溶液的作用是___,发生反应的化学方程式为_____。
(7)盛水的试管中,溶液最后的颜色为___,说明氯气____(填“能”或“不能”)溶于水。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com