
(14��)��ѧ��Ӧԭ���ڿ��к�ũҵ�������й㷺Ӧ�á�
��1��ij��ѧ��ȤС����й�ҵ�ϳɰ���ģ���о�����Ӧ�ķ���ʽΪN2(g)+3H2(g)  2NH3(g) ��H<0����lL�ܱ������м���0.1 mol N2��0.3mol H2��ʵ��١��ڡ�����c(N2)��ʱ��(t)�ı仯����ͼ��ʾ��
2NH3(g) ��H<0����lL�ܱ������м���0.1 mol N2��0.3mol H2��ʵ��١��ڡ�����c(N2)��ʱ��(t)�ı仯����ͼ��ʾ��
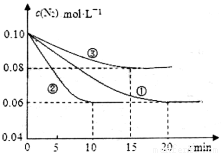
ʵ��ڴӳ�ʼ��ƽ��Ĺ����У��÷�Ӧ��ƽ����Ӧ����v(NH3)=__________________����ʵ�����ȣ�ʵ��ں�ʵ������ı��ʵ�������ֱ�Ϊ����ѡ���е�__________��__________(����ĸ���)��
A������ѹǿ
B����Сѹǿ
C�������¶�
D�������¶�
E��ʹ�ô���
��2����֪NO2��N2O4�����ת����2NO2(g) N2O4(g)��
N2O4(g)��
��T��ʱ����0.40 mol NO2��������ݻ�Ϊ2L���ܱ������У��ﵽƽ����������c(N2O4)=0.05 mol/L����÷�Ӧ��ƽ�ⳣ��K=_______________��
����֪N2O4�ڽϸ��¶��������ȶ����ڣ���ת��ΪNO2���������¶ȣ�������Ӧ��ƽ�ⳣ��K��_____________(���������С�����䡱)��
��������ܱ�������ͨ��һ������NO2��ijʱ���������Ӧ������ʱ�ʵı仯��ͼ��ʾ������˵����ȷ����__________(����ĸ���)��
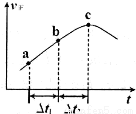
A����Ӧ��c��ﵽƽ��״̬
B����Ӧ��Ũ�ȣ�a��С��b��
C����t1=��t2ʱ��NO2��ת���ʣ�a��b��С�� b��c��
��3��25��ʱ����amol/L�İ�ˮ��b mol/L����������ϣ���Ӧ����Һǡ�������ԣ���a______b�� (�>������<����=��)����a��b��ʾNH3 H2O�ĵ���ƽ�ⳣ��Kb=________________��
H2O�ĵ���ƽ�ⳣ��Kb=________________��
��14�֣���1��0.008 mol/(L��min)��2�֣���E��1�֣���C��1�֣�
��2����5L/mol��2�֣� �ڼ�С��2�֣�����C��2�֣���
��3������2�֣�  ��2�֣�
��2�֣�
��������
�����������1������ͼʾ��֪ʵ��ڴӳ�ʼ��ƽ��Ĺ����У��÷�Ӧ��ƽ����Ӧ����v(N2)=(0.1mol/L��0.06mol/L)��10min=0.004mol/(L��min),����v(NH3)��v(N2)=2:1������v(NH3)=2 v(N2)= 0.008mol /(L��min)����ʵ�����ȣ�ʵ��ڴﵽƽ������Ҫ��ʱ��̣���Ӧ���ʿ죬�����ʵ�ƽ��Ũ��û�б仯��˵��ƽ��û�з����ƶ��������ı��ʵ�������Ǽ��������ѡ����E����ʵ��۴ﵽƽ������Ҫ��ʱ��̣���Ӧ���ʿ죬������N2��ƽ��Ũ�ȱȢٸߣ�˵��ƽ�����淴Ӧ�����ƶ������ı��ʵ�������������¶ȣ�ѡ����C����2����֪NO2��N2O4�����ת����2NO2(g)  N2O4(g)����T��ʱ����0.40 mol NO2��������ݻ�Ϊ2L���ܱ������У��ڷ�Ӧ��ʼʱc(NO2)=0.20mol/L.�ﵽƽ����������c(N2O4)=0.05 mol/L�����ݷ���ʽ�����ʷ�Ӧ�Ĺ�ϵ��֪������?c(NO2)=0.10mol/L.������c(NO2)(ph)=0.10mol/L.��÷�Ӧ��ƽ�ⳣ��K=
N2O4(g)����T��ʱ����0.40 mol NO2��������ݻ�Ϊ2L���ܱ������У��ڷ�Ӧ��ʼʱc(NO2)=0.20mol/L.�ﵽƽ����������c(N2O4)=0.05 mol/L�����ݷ���ʽ�����ʷ�Ӧ�Ĺ�ϵ��֪������?c(NO2)=0.10mol/L.������c(NO2)(ph)=0.10mol/L.��÷�Ӧ��ƽ�ⳣ��K= (mol/L)������֪N2O4�ڽϸ��¶��������ȶ����ڣ���ת��ΪNO2��˵�������¶ȣ�ƽ�������ƶ�������ƽ���ƶ�ԭ���������¶ȣ�ƽ�������ȷ�Ӧ�����ƶ�������Ӧ�Ƿ��ȷ�Ӧ���������¶�������Ӧ��ƽ�ⳣ��K����С����A������ͼ���֪����Ӧ������ʱ����ӳ������ߣ�˵����Ӧ������У���Ӧ��c��ʱ��ʾ�����������ʱ��Ӧ���ܴ���ƽ��״̬��Ҳ����δ�ﵽ�жϣ��ӳ������жϷ�Ӧ�Ƿ���ƽ��״̬������B�����ڷ�Ӧ�Ǵ�����Ӧ����ʼ�ģ����Է�Ӧ���Ũ�Ȼ���С�����ﵽƽ��ʱ�ﵽ��Сֵ�����Է�Ӧ��Ũ�ȣ�a�����b�㣬����C����������Ӧ�Ƿ��ȷ�Ӧ�����Ԧ�t1=��t2ʱ���¶���b��c�θ���a��b�Σ���Ϊ�¶ȶ����ʵ�Ӱ�����Ũ�ȵ�Ӱ�죬����NO2��ת���ʣ�a��b��С�� b��c�Σ���ȷ����3��25��ʱ����amol/L�İ�ˮ��b mol/L����������ϣ������ߵ����ʵ�����ȣ���Ӧǡ�ò���NH4Cl��������ǿ�������Σ�ˮ��ʹ��Һ�����ԣ�����Ӧ����Һǡ�������ԣ���ˮӦ��������������a��b��NH3��H2O
(mol/L)������֪N2O4�ڽϸ��¶��������ȶ����ڣ���ת��ΪNO2��˵�������¶ȣ�ƽ�������ƶ�������ƽ���ƶ�ԭ���������¶ȣ�ƽ�������ȷ�Ӧ�����ƶ�������Ӧ�Ƿ��ȷ�Ӧ���������¶�������Ӧ��ƽ�ⳣ��K����С����A������ͼ���֪����Ӧ������ʱ����ӳ������ߣ�˵����Ӧ������У���Ӧ��c��ʱ��ʾ�����������ʱ��Ӧ���ܴ���ƽ��״̬��Ҳ����δ�ﵽ�жϣ��ӳ������жϷ�Ӧ�Ƿ���ƽ��״̬������B�����ڷ�Ӧ�Ǵ�����Ӧ����ʼ�ģ����Է�Ӧ���Ũ�Ȼ���С�����ﵽƽ��ʱ�ﵽ��Сֵ�����Է�Ӧ��Ũ�ȣ�a�����b�㣬����C����������Ӧ�Ƿ��ȷ�Ӧ�����Ԧ�t1=��t2ʱ���¶���b��c�θ���a��b�Σ���Ϊ�¶ȶ����ʵ�Ӱ�����Ũ�ȵ�Ӱ�죬����NO2��ת���ʣ�a��b��С�� b��c�Σ���ȷ����3��25��ʱ����amol/L�İ�ˮ��b mol/L����������ϣ������ߵ����ʵ�����ȣ���Ӧǡ�ò���NH4Cl��������ǿ�������Σ�ˮ��ʹ��Һ�����ԣ�����Ӧ����Һǡ�������ԣ���ˮӦ��������������a��b��NH3��H2O NH4++OH-�����ﵽ����ƽ��ʱc(NH3��H2O)=(a-b)mol/L��c(OH-)=10-7mol/L������NH3
NH4++OH-�����ﵽ����ƽ��ʱc(NH3��H2O)=(a-b)mol/L��c(OH-)=10-7mol/L������NH3 H2O�ĵ���ƽ�ⳣ��Kb=
H2O�ĵ���ƽ�ⳣ��Kb=
 ��
��
���㣺���黯ѧ��Ӧ���ʵļ��㡢����ѧƽ��״̬���жϡ�Ӱ�컯ѧƽ������ء����ʵĵ���ƽ������ı���ʽ����д��֪ʶ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�긣��ʡ������ѧ�ڵ��Ĵ��¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
����ʵ����������Ӧ���۾���ȷ����
ѡ�� | ���� | ���� | ���� |
A | ��Ũ����ε����DZ��� | ���������� | Ũ��������ˮ�Ժ�ǿ������ |
B | �����½�AlƬ����Ũ������ | �����Ա仯 | Al��Ũ�����Ӧ |
C | ��������ͨ��Ʒ����Һ�� | Ʒ����Һ��ɫ | ����������л�ԭ�� |
D | ��ˮ����ͨ�����ȵ����� | ��ĩ��� | ����ˮ�ڸ����·�����Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���㽭ʡ������ѧ��10���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��X��Y��Z��W��M���ֶ�����Ԫ�أ�����X��Y��Z��Wͬ���ڣ� Z��Mͬ���壻 X+��M2-������ͬ�ĵ��Ӳ�ṹ�����Ӱ뾶��Z2-��W-��Y�ĵ��ʾ����۵�ߡ�Ӳ�ȴ���һ����Ҫ�İ뵼����ϡ�����˵���У���ȷ����
A��X��M����Ԫ��ֻ���γ�X2M�ͻ�����
B��Ԫ��Y��Z��W�ĵ��ʾ�������ͬ�����͵ľ���
C��Ԫ��W��M��ijЩ���ʿ���Ϊˮ�����е�������
D������W��Z��MԪ�ص��⻯����Է����������μ�С��������е����ν���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���Ĵ�ʡ�����и���һ��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��ҵ�������о�����CO2�������״�ȼ�ϣ��÷����Ļ�ѧ����ʽΪCO2(g)+3H2(g) CH3OH(g)+H2O(g) ?H=��49.0kJ/mol��һ���¶��£��������ݻ���Ϊ3.0L�ĺ����ܱ������з����÷�Ӧ��
CH3OH(g)+H2O(g) ?H=��49.0kJ/mol��һ���¶��£��������ݻ���Ϊ3.0L�ĺ����ܱ������з����÷�Ӧ��
���� | ��ʼ���ʵ�����mol | ƽ�����ʵ�����mol | |||
��� | �¶ȣ��� | CO2(g) | H2(g) | CH3OH(g) | H2O(g) |
�� | T1 | 3 | 4 | 0.5 | 0.5 |
�� | T1 | 1.5 | 2 | ||
�� | T2 | 3 | 4 | 0.8 | 0.8 |
�����й�˵������ȷ����
A��������2min����I�з�Ӧ��ƽ�⣬��2min��ƽ������V(H2)=0.25 mol��(L��min)
B���ﵽƽ��ʱ������I��CO2ת���ʵı�������Ĵ�
C���ﵽƽ��ʱ���������з�Ӧ�ų����������������2����
D�����������ж�Ӧ�����µ�ƽ�ⳣ���ֱ�ΪK1��K2��K3����K1=K2<K3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���Ĵ�ʡ�����и���һ��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
���������й��������鹲������۲���ȷ����
ѡ�� | ���� | ������ | ���� |
A | ��FeCl3����Һ�� | H+��H2O2��Cl- | �ᷢ����Ӧ�����Բ��ܴ������� |
B | ����ʱ��pH=ll����Һ�� | Na+��ClO-��AlO2- | �ܴ������� |
C | ˮ�����c(H+)=1��10-6mol/L����Һ�� | Al3+��NH4+��NO3- | ���ܴ������� |
D | ij��ɫ��Һ�� | Na+��HCO3-��OH- | �����CO2�����Բ��ܴ������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ��ɽ��ʡ�����и���12��У�����ϼ�⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
���и���ʵ��������������ó��Ľ��ۣ���ȷ����
ѡ�� | ʵ����� | ʵ������ | ���� |
A | ��ij������Һ�еμ�ϡ���� | �����ܹ�ʹʯ��ˮ����ǵ����� | ����Һ��һ������CO32-��HCO3- |
B | KIO3��Һ�м���HI��Һ����������� | ��Һ����ɫ | KIO3�������Ա�I2ǿ |
C | ��Na2S��Һ�еμ����� | ������������ζ������ | �ȵķǽ����Ա���ǿ |
D | CO��ԭFe2O3�õ��ĺ�ɫ������������ܽ���ټ���KSCN��Һ | ��Һ���Ժ�ɫ | ��ɫ��������Fe3O4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ��ɽ��ʡ�����и���12��У�����ϼ�⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
�ס��������ֳ����Ļ����X��Y��Z�����ֳ����ĵ��ʡ��±����и��������У�����֮��ͨ��һ����Ӧ����ʵ����ͼ��ʾת������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ��ɽ��ʡ�����и���12�¼�����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
һԪ��ǿ�������(H3PO2)��һ�־�ϸ������Ʒ������˵����ȷ����
A��������ĵ��뷽��ʽΪH3PO2 3H++PO23-
3H++PO23-
B����������P�Ļ��ϼ�Ϊ+1
C��NaH2PO2����ʽ��
D��NaH2PO2��Һ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�긣��ʡ������ѧ��12���¿���ѧ�Ծ��������棩 ���ͣ������
(8��)��ҵ��������淋�����ͼ���£���ش��������⣺
��1��д��������ڹ�ũҵ�����е���Ҫ����_____________________________(��дһ��)��

��2����֪N2��g��+3H2��g�� 2NH3��g������H����92.4 kJ��mol��1��
2NH3��g������H����92.4 kJ��mol��1��
��һ���¶�ѹǿ��������������һ�ܱ������г���1molN2��3molH2,��ַ�Ӧ��,�ų�������___________(�<�� ��>�� ��=��)92.4kJ�������� ��
��3��д�����������Ļ�ѧ����ʽ��___________________________________________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com