
【题目】过氧化氢(H2O2)的水溶液俗称双氧水。双氧水常被称为化学反应中的“绿色试剂”。已知,在含少量I-的溶液中,H2O2会较快分解,反应如下:反应①:H2O2+I- → H2O+IO-; 反应②:H2O2+IO- → H2O+O2+I-,完成下列填空:
(1)反应①中的氧化产物是_________,被还原的元素是___________。
(2)标出反应②中电子转移的方向和数目。_______________
(3)H2O2分解过程中,I-的作用是__________。
(4)根据反应①和反应②,请说明双氧水被称为“绿色试剂”的主要原因是_____。
(5)H2O2是一种二元弱酸,写出第一步电离的电离方程式:________,双氧水可漂白纤维织物,目前认为是其中过氧化氢离子(HOO-)的作用。为了增强其漂白效果,应选择在____(填“酸”、“碱”或“中”)性条件下进行。
(6)向盐酸酸化的FeCl2溶液中加入双氧水,溶液由浅绿色变为棕黄色,写出该变化的化学反应方程式:_____________。
【答案】IO- 负一价的O ![]() 催化剂 H2O2的氧化产物是O2,还原产物是H2O,都不会污染环境 H2O2
催化剂 H2O2的氧化产物是O2,还原产物是H2O,都不会污染环境 H2O2![]() H++HO2- 碱 2FeCl2 + H2O2 + 2HCl → 2FeCl3 + 2H2O
H++HO2- 碱 2FeCl2 + H2O2 + 2HCl → 2FeCl3 + 2H2O
【解析】
H2O2中-1价的氧,既可得电子成-2价(H2O或OH-),生成表现较强的氧化性;也可失电子成0价(O2),表现还原性。总反应的催化剂在分步反应中,先作反应物、后作生成物。
(1)反应①中,I-→ IO-,碘元素失电子,IO-是氧化产物;H2O2→ H2O+IO-,氧元素得电子被还原。
(2)反应②中,H2O2→O2,氧元素失电子;IO-→ I-,碘元素得电子。电子转移的方向和数目可表示为![]() 。
。
(3)反应①与反应②相加,得H2O2分解反应2H2O2= 2H2O+O2↑。I-是①的反应物、②的生成物,故为总反应的催化剂。
(4)反应①中H2O2被还原成H2O,反应②中H2O2被氧化成O2,H2O、O2都不会污染环境。故双氧水被称为“绿色试剂”。
(5)H2O2是一种二元弱酸,则其电离分步且可逆,第一步电离方程式为H2O2![]() H++HO2-。双氧水可用于漂白,要增强其漂白效果,应提高过氧化氢离子(HOO-)的浓度。故选择在碱性条件,使电离平衡右移。
H++HO2-。双氧水可用于漂白,要增强其漂白效果,应提高过氧化氢离子(HOO-)的浓度。故选择在碱性条件,使电离平衡右移。
(6)向盐酸酸化的FeCl2溶液中加入双氧水,Fe2+(浅绿色)被氧化成Fe3+(棕黄色),化学方程式2FeCl2+H2O2+2HCl → 2FeCl3+2H2O。


科目:高中化学 来源: 题型:
【题目】前四周期原子序数依次增大的元素A、B、C、D、E中,A的基态原子核外3 个能级上有电子,且每个能级上的电子数相等,B原于核外电子有7 种不同的运动状态,C元素原于核外的M层中只有2对成对电子,D+与C2-的电子数相等,E元素位于元素周期表的ds区,且基态原子价层电子均已成对。
回答下列问题:
(1)E2+ 的价层电子排布图为_____________________。
(2)五种元素中第一电离能最小的是_______________(填元素符号),CAB-离子中,A原子的杂化方式是______________________。
(3)AB-、D+ 和E2+三种离子组成的化学物质D2E(AB)4,其中化学键的类型有_______,该化合物中存在一个复杂离子,该离子的化学式为_________________,配位体是_____________________。
(4)C和E两种元素组成的一种化合物的晶胞如图所示。

①该化合物的化学式为________,E的配位数为______________,C采取_______(填“简单立方”、“体心立方”、“六方最密”或“面心立方最密”)堆积。
②列式表示该晶体的密度:_______________ g·㎝-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,分别向NaX溶液和YCl溶液中加入盐酸和氢氧化钠溶液,混合溶液的PH与离子浓度变化关系如图所示,下列说法不正确的是( )
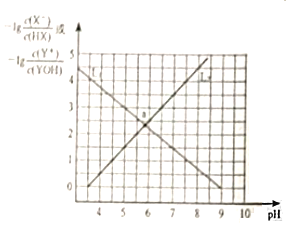
A.0.1mol/L的YX溶液中离子浓度关系为:c(Y+)>c(X-)>c(OH-)>c(H+)
B.L1表示-lg![]() 与pH的变化关系
与pH的变化关系
C.Kb(YOH)=10-10.5
D.a点时两溶液中水的电离程度不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】G(异戊酸薄荷醇酯)是一种治疗心脏病的药物。其合成路线如下:
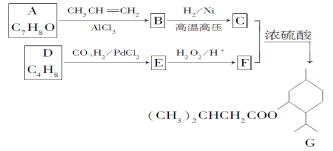
已知:①A能与氯化铁溶液发生显色反应;②RCH=CH2+CO+H2![]() RCH2CH2CHO;③
RCH2CH2CHO;③![]() ;
;
④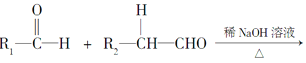
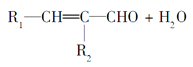 。
。
(1)A的名称为________。
(2)G中含氧官能团名称为________。
(3)D的分子中含有________种不同化学环境的氢原子。
(4)正戊醛可用作香料、橡胶促进剂等,写出以乙醇为原料制备CH3(CH2)3CHO的合成路线流程图(无机试剂任选)。合成路线流程图示例如下: H2C=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH______________
CH3CH2OH______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】变色眼镜的镜片中加有适量的AgBr和CuO。在强太阳光下,因产生较多的Ag而变黑:2AgBr![]() 2Ag+Br2,室内日光灯下镜片几乎呈无色。下列分析错误的是
2Ag+Br2,室内日光灯下镜片几乎呈无色。下列分析错误的是

A.强太阳光使平衡右移
B.变色原因能用勒沙特列原理解释
C.室内日光灯下镜片中无Ag
D.强太阳光下镜片中仍有AgBr
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生下列反应aA(g)![]() cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是( )
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是( )
A. 平衡向正反应方向移动B. a<c+d
C. D的体积分数变大D. A的转化率变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B为常见的浓酸溶液;X、Y、Z、W均为氧化物,其中X是红棕色气体,Y的固体可用于人工降雨,W既能使澄清石灰水变浑浊,又能使品红溶液褪色。根据如图所示转化关系(反应条件略),回答下列问题:
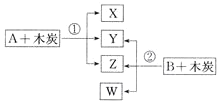
(1)Y是__________(填化学式)。
(2)将B露置在空气中一段时间,溶液质量增加但溶液浓度降低,表明B具有_____性;利用这种性质可以进行______(填字母)实验操作。
![]() 干燥二氧化硫
干燥二氧化硫 ![]() 检验
检验![]() c 干燥氨气
c 干燥氨气 ![]() 钝化铝片
钝化铝片
(3)写出X与Z的反应方程式:________________。
(4)W具有漂白性,氯水也有漂白性,两者同时使用,漂白效果将_________(填“增强”或“减弱”),原因是____________(用化学方程式表示)。
(5)反应①中氧化产物和还原产物的物质的量之比为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一.对下列实验事实的解释不正确的是
现象 | 解释或结论 | |
A | SO2使酸性高锰酸钾溶液褪色 | SO2表现还原性 |
B | 铝片放入浓硫酸中,无明显变化 | 说明铝与冷的浓硫酸不发生化学反应 |
C | 某溶液中加入浓NaOH溶液加热,放出气体能使湿润的红色石蕊试纸变蓝 | 该溶液中一定含有NH |
D | 浓HNO3在光照条件下变黄 | 浓HNO3不稳定,生成有色产物能溶于浓硝酸 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲酸香叶酯是一种食品香料,可以由香叶醇与甲酸发生酯化反应制得。下列说法正确的是( )
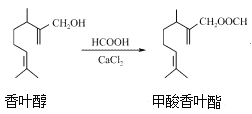
A. 香叶醇的分子式为C11H18O
B. 香叶醇在浓硫酸、加热条件下可发生消去反应
C. 香叶醇与CH2=CHCH=CHCH2OH互为同系物
D. 香叶醇与甲酸香叶酯均不能发生银镜反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com