
| A、苯酚钠溶液中通入少量CO2:C6H5O-+CO2+H2O→C6H5OH+HCO3- | ||
| B、在碳酸氢钠溶液中加入过量的氢氧化钡溶液:Ba2++OH-+HCO3-═BaCO3↓+H2O | ||
C、用新制的氢氧化铜悬浊液检验乙醛中的醛基:CH3CHO+2Cu(OH)2+OH-
| ||
| D、向Ca(ClO)2溶液中通入过量SO2:Ca2++2ClO-+SO2+H2O=CaSO4↓+2H++Cl-+HClO |
| △ |


科目:高中化学 来源: 题型:
A、NF3的形成过程用电子式可表示为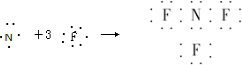 |
| B、NF3的氧化性大于F2 |
| C、NF3分子空间构型为三角锥形 |
| D、NH4F中既有离子键又有极性共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
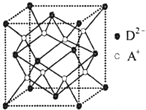 有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等子中子数.R是由A、D两元素形成的离子化合物,其中A+与D2-离子数之比为2:1.谙冋答下列问题:
有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等子中子数.R是由A、D两元素形成的离子化合物,其中A+与D2-离子数之比为2:1.谙冋答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
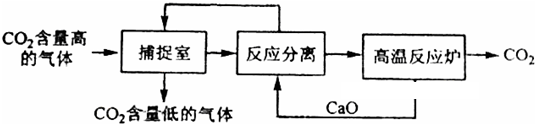
查看答案和解析>>
科目:高中化学 来源: 题型:
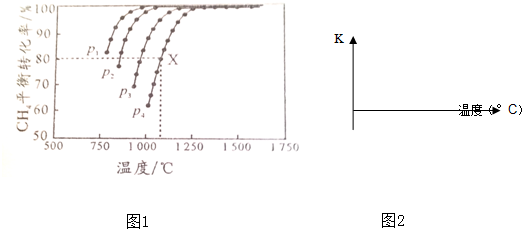 .
.查看答案和解析>>
科目:高中化学 来源: 题型:
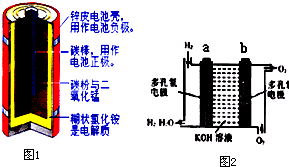
| 放电 |
| 充电 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com