
【题目】以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如下:

回答下列问题:
(1)酸溶时,粉碎硫酸渣的目的是_________________________________________。
(2)还原过程中加入FeS2粉增大溶液中Fe2+的含量,同时有H2SO4生成,完成该反应的离子方程式:_________FeS2+14Fe3++______H2O═15Fe2++______SO42-+______.
(3)滤渣A的主要成分为_________。
(4)生产过程中,为了确保铁红的纯度,氧化过程需要调节溶液的pH的范围是___________;(部分阳离子以氢氧化物形式沉淀时溶液的pH见下表)
沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 |
完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 |
为得到纯净的Fe(OH)3固体,需要对沉淀进行洗涤,判断沉淀Fe(OH)3是否洗净的方法是____________________。
(5)当离子浓度≤1×10-5mol/L时可认为其沉淀完全。若要使Mg2+完全沉淀则要保持c(OH-)≥_____________。(已知Ksp[Mg(OH)2]=5.6×10-12,![]() )
)
【答案】增大接触面积,加快溶解速率 FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+ SiO2 3.2—3.8 取少量最后一次洗涤液于洁净的试管中,滴加少量BaCl2溶液,若无明显现象,则沉淀已洗净 7.5×10-4mol/L
【解析】
硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,硫酸渣中加入稀硫酸,Fe2O3、Al2O3、MgO都能溶于稀硫酸生成可溶性的硫酸盐,SiO2和稀硫酸不反应,加入FeS2,Fe3+和FeS2发生氧化还原反应生成Fe2+,过滤,滤渣A中主要成分是SiO2,滤液中含有Fe2+、Mg2+、Al3+,向滤液中加入NaOH、通入空气,且控制溶液pH,将Fe2+转化为Fe(OH)3沉淀,再次过滤,滤液B中含有Mg2+、Al3+,滤渣中含有Fe(OH)3,然后洗涤、烘干,烘干时Fe(OH)3分解生成Fe2O3,研磨得到Fe2O3即铁红。
(1). 酸溶时,粉碎硫酸渣能增大反应物的接触面积,加快反应速率,故答案为:增大接触面积,加快溶解速率;
(2). 加入FeS2,Fe3+和FeS2发生氧化还原反应生成Fe2+,同时有H2SO4生成,根据得失电子守恒和原子守恒,该反应的离子方程式为:FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+,故答案为:FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+;
(3). 二氧化硅不溶于稀硫酸,滤渣A的主要成分是SiO2,故答案为:SiO2;
(4). 根据几种离子沉淀的pH,使Fe3+沉淀完全的pH为3.2,Al3+开始沉淀的pH为3.8,因此为了确保铁红的纯度,氧化过程需要调节溶液的pH的范围是3.2—3.8,氢氧化铁吸附的阴离子有硫酸根离子,可用氯化钡溶液检验硫酸根离子,其检验方法为取少量最后一次洗涤液于洁净的试管中,滴加少量BaCl2溶液,若无明显现象,则沉淀已洗净,故答案为:3.2—3.8;取少量最后一次洗涤液于洁净的试管中,滴加少量BaCl2溶液,若无明显现象,则沉淀已洗净;
(5). 若使Mg2+完全沉淀,则要保持c(OH)![]() =
=![]() mol/L=7.5×104mol/L,故答案为:7.5×104mol/L。
mol/L=7.5×104mol/L,故答案为:7.5×104mol/L。


 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源: 题型:
【题目】取两份铝片,第一份与足量盐酸反应,第二份与足量烧碱溶液反应,同温同压下放出相同体积的气体,则消耗的HCl和NaOH的物质的量之比为( )
A.1:1B.2:1C.3:1D.1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应3Cl2+6NaOH![]() 5NaCl+NaClO3+3H2O,以下叙述正确的是( )
5NaCl+NaClO3+3H2O,以下叙述正确的是( )
A. Cl2既做氧化剂又做还原剂
B. 被氧化的氯原子和被还原的氯原子的物质的量之比为5∶1
C. Cl2是氧化剂,NaOH是还原剂
D. 氧化剂得电子数与还原剂失电子数之比为5∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为了探究铬和铁的活泼性,设计如图所示装置,下列推断合理的是( )
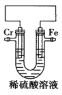
A. 若铬比铁活泼,则电子经外电路由铁电极流向铬电极
B. 若铁比铬活泼,则溶液中H+向铁电极迁移
C. 若铬比铁活泼,则铁电极反应式为2H++2e-=H2↑
D. 若铁电极附近溶液pH增大,则铁比铬活泼
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列说法正确的是( )
A. 将 (NH4)2SO4、CuSO4溶液分别加入蛋白质溶液,都出现沉淀可知二者均可使人中毒
B. 塑料的老化是由于与空气中的氧气发生了加成反应
C. 粮食酿酒的过程:淀粉![]() 葡萄糖
葡萄糖![]() 乙醇
乙醇
D. 可以用足量氢氧化钠溶液加热的方法区分地沟油(分离过的餐饮废弃油)与矿物油(汽油、煤油、柴油等)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯是一种重要的化工原料,也是一种重要的溶剂。请回答下列问题:

(1)上图是某些有机物的结构模型,其中表示为苯的是_____。
(2)向2mL苯中加入1mL溴水,震荡、静置,实验现象为_____。
(3)在一定条件下,苯能发生多种取代反应。写出苯生成硝基苯的化学方程式____。
(4)在一定条件下,苯可以由乙炔制得,写出乙炔与足量的H2在加热加压,Ni做催化剂的条件下反应生成乙烷的化学方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组同学对有关物质的分类进行讨论辨析:①Na2O2、MgO都属于碱性氧化物; ②在常温下,NaHCO3溶液、NaHSO4溶液的pH值皆小于7;③司母戊鼎、氯水皆属于混合物;④由非金属元素组成的化合物可能属于盐。上述说法中正确的是( )
A.①②B.①④C.②③D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容密闭容器中,当容器中的下列物理量不再变化时,表明反应:A(s)+2B(g)![]() C(g)+D(g)已达平衡的是( )
C(g)+D(g)已达平衡的是( )
A. 混合气体的压强 B. 混合气体的密度 C. B的物质的量浓度 D. 气体的总物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在地壳中SiO2和HF存在以下平衡:SiO2(s)+4HF(g)![]() SiF4(g)+2H2O(g)ΔH=-148.9kJ·mol-1。
SiF4(g)+2H2O(g)ΔH=-148.9kJ·mol-1。
(1)如果该反应在体积不变的密闭容器中发生,当反应达到平衡时_______(填字母)。
a.2v正(HF)=v逆(H2O) b.v(H2O)=2v(SiF4)
c.SiO2的质量保持不变 d.反应物不再转化为生成物
(2)若反应容器容积为2.0L,反应时间8.0min,容器内气体的密度增大了0.12g·L-1,在这段时间内HF的平均反应速率为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com