
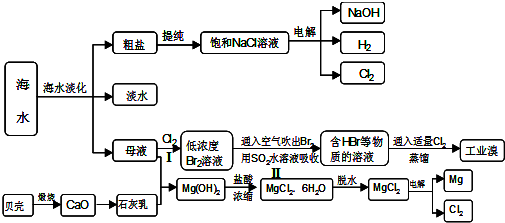
分析 (1)海水淡化即利用海水脱盐生产淡水的过程;
(2)溴单质具有氧化性,二氧化硫具有还原性,二者可以发生反应;
(3)氯化镁中的镁离子易水解,在酸性环境下可以抑制水解;
(4)根据能和金属镁发生反应的气体来回答;
(5)工业上,电解熔融的氧化铝可以获得金属铝.
解答 解:(1)海水淡化即利用海水脱盐生产淡水的过程,常见的方法有:蒸馏法、膜法、冷冻法、离子交换法等,故答案为:蒸馏法、电渗析法、离子交换法等;
(2)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,是为了富集溴元素,用SO2水溶液吸收Br2的原理方程式为Br2+SO2+2H2O=4H++SO42-+2Br-,
故答案为:富集溴元素;Br2+SO2+2H2O=4H++SO42-+2Br-;
(3)氯化镁中的镁离子易水解,在干燥的HCl气流中,抑制了MgCl2水解,且带走MgCl2•6H2O受热产生的水汽,故能得到无水MgCl2,
故答案为:在干燥的HCl气流中,抑制了MgCl2水解,且带走MgCl2•6H2O受热产生的水汽,故能得到无水MgCl2;
(4)能和金属镁发生反应的气体:氮气、氧气、二氧化碳、水,所以可以用氢气做镁蒸气的冷却剂,故答案为:A;
(5)工业上,电解熔融的氧化铝可以获得金属铝,原理方程式为2Al2O3(熔融)$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑,故答案为:2Al2O3(熔融)$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑.
点评 本题主要考查了海水制金属镁的过程以及原理,为高频考点,侧重于学生的分析能力和实验能力的考查,掌握实验的原理和操作方法结合流程图信息是解答本题的关键,题目难度中等.


 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:多选题
| A. | 某溶液$\stackrel{+AgNO_{3}溶液}{→}$生成白色沉淀,说明原溶液中含有Cl- | |
| B. | 某溶$\stackrel{+HCl溶液}{→}$无现象$\stackrel{+BaCl_{2}溶液}{→}$生成白色沉淀,+说明原溶液中含有SO42- | |
| C. | 某溶$\stackrel{+NaOH溶液}{→}$生成红褐色沉淀,说明原溶液中含有Fe3+ | |
| D. | 某溶$\stackrel{+稀硫酸}{→}$生成无色气体,说明原溶液中含有CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某课外小组分别用图所示装置对原电池和电解池原理进行实验探究.
某课外小组分别用图所示装置对原电池和电解池原理进行实验探究.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 不同时间各物质的物质的量/mol | ||||
| 0min | 2min | 4min | 6min | |
| CH4 | 2.00 | 1.76 | 1.60 | n2 |
| H2 | 0.00 | 0.72 | n1 | 1.20 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
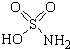 氨基磺酸(结构如图所示)是一种强酸,工业上用于酸性清洗剂、磺化剂等.加热至60℃时与水反应生成一种盐,该盐的溶液呈强酸性.下列有关氨基磺酸说法正确的是( )
氨基磺酸(结构如图所示)是一种强酸,工业上用于酸性清洗剂、磺化剂等.加热至60℃时与水反应生成一种盐,该盐的溶液呈强酸性.下列有关氨基磺酸说法正确的是( )| A. | 不溶于水 | B. | 不能清洗铁锈 | ||
| C. | 水溶液中以分子形式大量存在 | D. | 与水反应生成的盐是NH4HSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
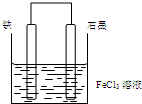
| A. | 电子从石墨棒经外电路流向铁棒 | |
| B. | 总反应为2Fe3++Fe=3 Fe2+ | |
| C. | 石墨电极上发生氧化反应 | |
| D. | 铁电极逐渐变细,石墨电极逐渐变粗 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5:3 | B. | 4:3 | C. | 3:4 | D. | 3:5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com