
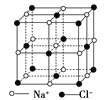
【题目】晶体具有规则的几何外形,晶体中最基本的重复单位称为晶胞。NaCl晶体结构如图所示。已知FexO晶体晶胞结构为NaCl型,由于晶体缺陷,x值小于1,测知FexO晶体密度ρ=5.71 g·cm-3,晶胞边长为4.28×10-10m。
(1)FexO中x值(精确至0.01)为________。
(2)晶体中的Fe分别为Fe2+、Fe3+,在Fe2+和Fe3+的总数中,Fe2+所占分数(用小数表示,精确至0.001)为________。
(3)此晶体的化学式为________。
(4)与某个Fe2+(或Fe3+)距离最近且等距离的O2-围成的空间几何形状是________。
(5)在晶体中,铁离子间最短距离为________cm。
【答案】 0.92 0.826 Fe![]() Fe
Fe![]() O 正八面体 3.03×10-8
O 正八面体 3.03×10-8
【解析】(1)由氯化钠晶胞可知在此晶胞中应有4个FexO,所以可得(56x+16)×4/NA=5.71×(4.28×10-8)3,解得x≈0.92。(2)设晶体中的Fe2+个数为y,,根据化合物中电荷守恒的原则,即正电荷总数等于负电荷总数可得:2y+3×(0.92-y)=2,解得y=0.76,所以可得Fe2+所占分数=0.76/0.92≈0.826。(3)含Fe3+个数为0.92-0.76=0.16,此晶体的化学式为![]() ;(4)根据氯化钠的结构可知与某个Fe2+(或Fe3+)距离最近且等距离的O2-位于面心处,围成的空间几何形状是正八面体;(5)由FexO晶体晶胞的结构及晶胞的边长可知,铁离子间最短距离为面对角线的一半,即为
;(4)根据氯化钠的结构可知与某个Fe2+(或Fe3+)距离最近且等距离的O2-位于面心处,围成的空间几何形状是正八面体;(5)由FexO晶体晶胞的结构及晶胞的边长可知,铁离子间最短距离为面对角线的一半,即为![]() ×4.28×10-10m≈3.03×10-10m=3.03×10-8cm。
×4.28×10-10m≈3.03×10-10m=3.03×10-8cm。


 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源: 题型:
【题目】下列各组离子在溶液中可大量共存的是( )
A. H+、SO42-、K+、OH-
B. H+、Ba2+、NO3-、SO42-
C. K+、Cl-、CO32-、Na+
D. Ca2+、NO3-、Na+、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、铝的混合物进行如下实验:

(1)操作X的名称是________________;
(2)气体A是___________(填化学式);
(3)溶液B中阴离子除OH- 外还有__________(填离子符号),溶液D中存在的金属离子为_________(填离子符号);
(4)加入足量NaOH溶液时发生反应的离子方程式为:_________;加入稀盐酸发生反应的离子方程式为:___________________________________________;
(5)向溶液D加入NaOH溶液,观察到产生的白色絮状沉淀迅速变为灰绿色,最终变为红褐色,请写出沉淀转化的化学方程式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
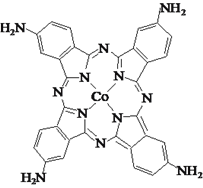
【题目】钴的化合物在磁性材料生产、电池制造、催化剂制备等方面应用十分广泛。
(1)二价钴离子的核外电子排布式为______。基态Co原子核外3d能级上有______个未成对电子。Co与Ca属同周期,且核外最外层电子构型相同,但金属钴熔沸点都比钙高,原因是______。
(2)0.1mol[Co(NO2)6]3-中所含的σ键数目是______,K3[Co(NO2)6]中K、N、O三种元素的第一电离能由大到小的顺序是______。
(3)化合物四氨基钴酞菁分子的结构式如图。四氨基钴酞菁中N原子的杂化轨道类型为______。
(4)[Co(NH3)6]Cl3晶体可由CoCl2溶于氨水并通入空气制得,该配合物中配体分子的立体构型是______。
(5)一种钴的化合物可用作石油脱硫的催化剂,其晶胞结构如图所示,则晶体中与每个O2-紧邻的O2-有______个,该钴的化合物的化学式是______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用“双桥法”表示下列氧化还原反应中电子转移的方向和数目,并指出氧化剂和还原剂。2KClO3 === 2KCl+3O2↑ _______氧化剂_____ 还原剂_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二醛是一种低级醛,它有着极其活跃的化学反应性,并有广泛的用途。
I.乙二醛的工业制法如下:
(1)乙醛(CH3CHO)液相硝酸氧化法
在Cu(NO3)催化下,用稀硝酸氧化乙醛制取乙二醛,反应的离子方程式为___________。该法具有原料易得、反应条件温和等优点,但也存在比较明显的缺点是____________ 。
(2)乙二醇(HOCH2CH2OH)气相氧化法
①已知:OHC-CHO(g)+2H2(g)![]() HOCH2CH2OH(g) △H=-78kJ/mol K1
HOCH2CH2OH(g) △H=-78kJ/mol K1
2H2(g)+O2(g)![]() 2H2O(g) △H=-484kJ/mol K2
2H2O(g) △H=-484kJ/mol K2
乙二醇气相氧化反应HOCH2CH2OH(g)+O2(g)![]() OHC-CHO(g)+2H2O(g)的相同温度下,该反应的化学平衡常数K=___(用含K1、K2的代数式表示)。
OHC-CHO(g)+2H2O(g)的相同温度下,该反应的化学平衡常数K=___(用含K1、K2的代数式表示)。
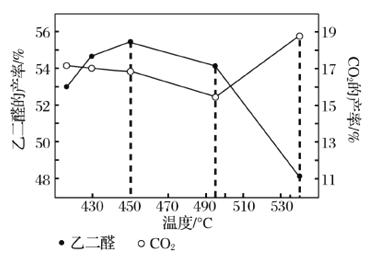
②当原料气中氧醇比为1.35时,乙二醛和副产物CO2的产率与反应温度的关系如图所示。反应温度在450~495℃之间和超过495℃时,乙二醛产率降低的主要原因分别是____、____。
II.乙二醛的用途之一是可以电解氧化制备乙醛酸(OHC-COOH),其生产装置如图所示,通电后,阳极产生的Cl2与乙二醛溶液反应生成乙醛酸。
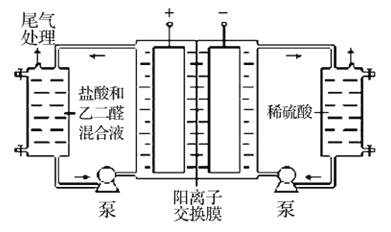
(3)阴极反应式为_________。
(4)阳极液中盐酸的作用,除了产生氯气外,还有__________作用。
(5)保持电流强度为aA,电解tmin,制得乙醛酸mg,列式表示该装置在本次电解中的电流效率η=__________ (已知:法拉第常数为fC·mol-l;![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于常温下pH=1的硝酸溶液,有关叙述:
①该溶液1mL稀释至100mL后,pH=3
②向该溶液中加入等体积、pH=13的氢氧化钡溶液恰好完全中和
③该溶液中硝酸电离出的c(H+)与水电离出的c(H+)之比值为1×10﹣12
④向该溶液中加入等体积、等浓度的氨水,所得溶液pH=7
其中正确的是
A. ①② B. ①③ C. ②④ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法中不正确的是
A. 某溫度时的混合溶液中C(H+) =![]() mol·L-1,说明该溶液呈中性(KW为该温度时水的离子积常数)
mol·L-1,说明该溶液呈中性(KW为该温度时水的离子积常数)
B. 常温下,由水电离出的c(H+)=10-12mol·L-1的溶液的PH可能为2或12
C. 已知Ksp(AgCl)=1.56×10-10。Ksp(Ag2CrO4)=9.0×10-12,向含有Cl-、CrO42-且浓度均为0.010mol·L-1溶液中逐滴加入0.010mol·L-1的AgNO3溶液时,Cl-先产生沉淀
D. 常温下PH=7的CH3COOH和CH3COONa混合溶液中,c(Na+)=c(CH3COO-)+c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一恒温、恒容的密闭容器中存在化学平衡:H2(g)+I2(g) ![]() 2HI(g),已知H2和I2的起始浓度均为0.10molL-1,达到平衡状态时HI的浓度为0.16molL-1。若H2和I2的起始浓度均变为0.20molL-1,则平衡时H2的浓度为( )
2HI(g),已知H2和I2的起始浓度均为0.10molL-1,达到平衡状态时HI的浓度为0.16molL-1。若H2和I2的起始浓度均变为0.20molL-1,则平衡时H2的浓度为( )
A. 0.16molL-1 B. 0.08 molL-1 C. 0.04 molL-1 D. 0.02molL-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com