
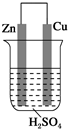
| A. | 铜极质量逐渐减少 | B. | 锌是正极,发生氧化反应 | ||
| C. | 电流从锌片经导线流向铜片 | D. | 阳离子向铜极移动 |
分析 Zn比Cu活泼,形成原电池反应时,Zn为负极,发生氧化反应,Cu为正极,正极上氢离子得电子发生还原反应,电子从负极流向正极,溶液中阳离子向正极移动,据此进行解答.
解答 解:Zn比Cu活泼,形成原电池反应时,Zn为负极,Cu为正极,
A.铜为正极,氢离子在正极得到电子生成氢气,则反应过程中铜极质量不变,故A错误;
B.Zn活泼性大于Cu,则Zn为负极,故B错误;
C.电流从正极流向负极,则电流从铜极流向锌,故C错误;
D.外电路中电流从Cu流向锌,溶液中阳离子向着铜极移动,故D正确;
故选D.
点评 本题考查了原电池工作原理,题目难度不大,明确正负极的判断方法、电子的流向、正负极发生的反应即可解答,注意掌握原电池原理,试题侧重考查学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 镁与盐酸反应放出氢气 | B. | 氢氧化钠与盐酸的反应 | ||
| C. | 浓硫酸与蔗糖混合 | D. | Ba(OH)2•8H2O与NH4Cl反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将纯水加热,水的离子积变大、pH变小,溶液呈酸性 | |
| B. | pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)相等 | |
| C. | Na2CO3溶液加水稀释后,恢复至原温度,pH增大 | |
| D. | 中和体积和pH都相等的HCl溶液和CH3COOH溶液所消耗的NaOH物质的量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同温度下,溶液中水的电离程度:溶液①<溶液② | |
| B. | 可用Na2CO3固体鉴别0.04mol•L-1醋酸和0.04mol•L-1盐酸 | |
| C. | 向①中加入少量CH3COONa固体,则$\frac{{K}_{a}}{c(C{H}_{3}CO{O}^{-})}$增大 | |
| D. | 加水稀释溶液③,溶液中$\frac{c(C{H}_{3}COOH)•c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com