
科目:高中化学 来源:2016届安徽省三校高三上学期二次模拟化学试卷(解析版) 题型:实验题
(15分)铁、铝及其化合物在生活、生产中有着广泛的应用。
Ⅰ.某研究性学习小组对某硫酸亚铁晶体(FeSO4•xH2O)热分解进行研究。该小组同学称取a g硫酸亚铁晶体样品按下图图1高温加热,使其完全分解,对所得产物进行探究,并通过称量装置B的质量测出x的值。
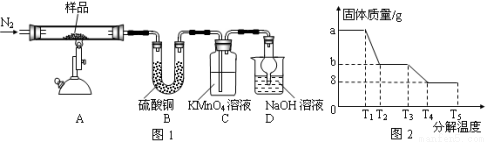
(1)装置B中硫酸铜粉末变蓝,质量增加12.6 g,说明产物中有水,装置C中高锰酸钾溶液褪色,说明产物中还有 。
(2)实验中要持续通入氮气,否则测出的x会 (填“偏大”、“偏小”或“不变”)。
(3)硫酸亚铁晶体完全分解后装置A中还残留红棕色固体Fe2O3。
(4)从理论上分析得出硫酸亚铁分解还生成另一种物质SO3,写出FeSO4分解的化学方程式 。
(5)某研究所利用SDTQ 600热分析仪对硫酸亚铁晶体(FeSO4•xH2O)进行热分解,获得相关数据,绘制成固体质量-分解温度的关系图如上图图2。根据两种热分解实验的有关数据,可计算出FeSO4•xH2O中的x= 。
Ⅱ.铝元素在自然界中主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。工业上用铝土矿制备铝的某种化合物的工艺流程如下。

(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
①检验滤液B中是否还含有铁元素的操作方法为: 。
②将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为 (填选项编号)。
a.氢氧化钠溶液 b.硫酸溶液 c.氨水 d.二氧化碳
③由滤液B制备氯化铝晶体涉及的操作为:
边滴加浓盐酸边蒸发浓缩、 (填操作名称)、过滤、洗涤。
(2)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为 (填选项编号)。

查看答案和解析>>
科目:高中化学 来源:2016届山东省高三上学期第一次月考化学试卷(解析版) 题型:选择题
火法炼铜的原理为Cu2S+O2 2Cu+SO2,下列说法中正确的是
2Cu+SO2,下列说法中正确的是
A.Cu2S只作还原剂
B.S元素发生还原反应
C.该反应既是氧化还原反应又是置换反应
D.当1 mol O2参加反应时,共转移4 mol e-
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省高二上学期半期考试化学试卷(解析版) 题型:选择题
为探究NaHCO3、Na2CO3和盐酸(以下盐酸浓度均为1 mol·L-1)反应过程中的热效应,实验测得如下数据:
序号 | 35 mL试剂 | 固体 | 混合前 温度/℃ | 混合后 温度/℃ |
① | 水 | 2.5 g NaHCO3 | 20.0 | 18.5 |
② | 水 | 3.2 g Na2CO3 | 20.0 | 24.3 |
③ | 盐酸 | 2.5 g NaHCO3 | 20.0 | 16.2 |
④ | 盐酸 | 3.2 g Na2CO3 | 20.0 | 25.1 |
由此得出的结论正确的是
A.Na2CO3溶液与盐酸的反应是吸热反应
B.NaHCO3溶液与盐酸的反应是放热反应
C.20.0 ℃时,含3.2 g Na2CO3的饱和溶液和35 mL盐酸混合后的温度将低于25.1 ℃
D.20.0 ℃时,含2.5 g NaHCO3的饱和溶液和35 mL盐酸混合后的温度将低于16.2 ℃
查看答案和解析>>
科目:高中化学 来源:2016届山东省青岛市高三上学期10月月考化学试卷(解析版) 题型:选择题
部分氧化的Fe-Cu合金样品(氧化产物为Fe2O3、CuO)共5.76 g,经如下处理:

下列说法正确的是
A.滤液A中的阳离子为Fe2+、Fe3+、H+
B.样品中Fe元素的质量为2.24 g
C.样品中CuO的质量为4.0 g
D.V=896
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏丹阳中学高二上10月月考化学试卷(解析版) 题型:实验题
(10分)实验室用如下图所示装置验证苯与溴反应的产物以及反应类型。
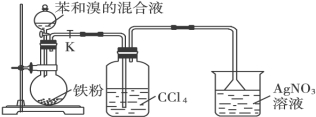
(1)由分液漏斗往烧瓶中滴加苯与溴的混合液时,反应很剧烈,可明显观察到烧瓶中充满了______________色气体。反应方程式: ;
(2)洗气瓶中产生的现象是: ,四氯化碳的作用是: ,如果省略洗气瓶, (填“能”或“不能”得到正确结论;
(3)则烧杯中产生的现象: ,说明苯与溴的反应是 反应;
(4)用离子方程式表示除去溴苯中溶解的溴: 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽师大附属中学高二上期中测试化学试卷(解析版) 题型:选择题
ZnC2、Al4C3、Mg2C3、Li2C2等与CaC2和H2O反应相似。下列说法不正确的是
A.C22-的电子式是 [ ]2-
]2-
B.Mg2C3和Li2C2与水反应生成的烃可能具有相同的官能团
C.1mol ZnC2与水反应生成的烃的体积约为22.4L
D.Al4C3与水反应生成的烃分子中只有极性键
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高二上第一次月考化学试卷(解析版) 题型:填空题
(1)将0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,该反应的热化学方程式为 。又已知:H2O(g)=H2O(l);△H2=-44.0kJ/mol,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是_____________kJ。
(2)已知:2NO2(g)  N2O4(g) ΔH1 2NO2(g)
N2O4(g) ΔH1 2NO2(g) N2O4(l) ΔH2
N2O4(l) ΔH2
下列能量变化示意图中,正确的是(选填字母)_____________。
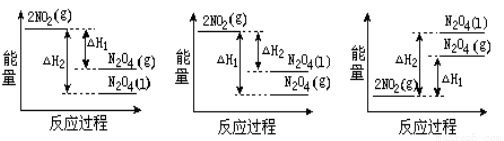
A B C
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:C(s,石墨)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1
2H2(g)+O2(g)===2H2O(l) ΔH2=-571.6 kJ·mol-1
2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH3=-2 599 kJ·mol-1
根据盖斯定律,计算298 K时由C(s,石墨)和H2(g)生成1 mol C2H2(g)反应的焓变(列出简单的计算式):___________________________。
(4)甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备甲醇气体(结构简式为CH3OH)。 已知某些化学键的键能数据如下表:
化学键 | C—C | C—H | H—H | C—O | C≡O | H—O |
键能/kJ·mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
已知CO中的C与O之间为叁键连接,则工业制备甲醇的热化学方程式为 ;
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省黄石市高二上学期10月月考化学试卷(解析版) 题型:选择题
反应A+3B=2C+D在四种不同情况下的反应速率分别为:①v(A) =0.15mol/(L·s) ;②v(B)=0.6mol/(L·min);③v(C)=0.5mol/(L·s);④v (D) =0.45mol/(L·s) ,则反应进行由快到慢的顺序为
A.④>③>①>② B.②>④>③>①
C.②>③>④>① D.④>③>②>①
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com