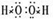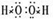A、B、C、D 四种元素的原子序数均≤20,A元素所处的周期数、主族序数、原子序数均相等;B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层少2个,C的阴离子与D的阳离子具有相同的电子层结构,两元素可形成化合物D2C.
(1)B在周期表中的位置为:______;
(2)A、B形成的化合物的结构式______,D2C含有的化学键类型为______,
用电子式表示D2C的形成过程______.
(3)C与D的原子中,半径更大的是:______(用相应的元素符号填空);
(4)A与D形成的化合物投入滴有酚酞的水中时,能剧烈反应产生气体,反应后溶液显红色.该反应的化学方程式为:______.
【答案】
分析:A元素所处的周期数、主族序数、原子序数均相等,应为H元素,B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO
3,则B为第二周期第ⅤA族,为N元素;C元素原子的最外层电子数比次外层少2个,应为S元素,C的阴离子与D的阳离子具有相同的电子层结构,两元素可形成化合物D
2C,则D为K元素,根据元素所在周期表中的位置结合元素周期律的递变规律解答该题.
解答:解:A元素所处的周期数、主族序数、原子序数均相等,应为H元素,B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO
3,则B为第二周期第ⅤA族,为N元素;C元素原子的最外层电子数比次外层少2个,应为S元素,C的阴离子与D的阳离子具有相同的电子层结构,两元素可形成化合物D
2C,则D为K元素,
(1)B为N元素,原子序数为7,原子核外有2个电子层,最外层电子数位5,则位于第二周期第ⅤA族,
故答案为:第二周期第ⅤA族;
(2)A、B形成的化合物为NH
3,分子的立体构型为三角锥形,结构式为
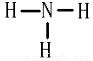
,D
2C为K
2S,为离子化合物,含有离子键,用电子式表示K
2S的形成过程为

,
故答案为:

;离子键;

;
(3)K原子核外有4个电子层,S原子核外有3个电子层电子层数越多,半径越大,故答案为:K;
(4)A与D形成的化合物为KH,具有强还原性,与水反应生成KOH和氢气,反应的化学方程式为KH+H
2O=H
2↑+KOH,
故答案为:KH+H
2O=H
2↑+KOH.
点评:本题考查位置结构性质的相互关系应用,题目难度不大,注意正确推断元素所在周期表中的位置,把握周期律的递变规律为解答该题的关键.

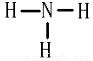 ,D2C为K2S,为离子化合物,含有离子键,用电子式表示K2S的形成过程为
,D2C为K2S,为离子化合物,含有离子键,用电子式表示K2S的形成过程为 ,
, ;离子键;
;离子键; ;
;



 有A、B、C、D四种短周期元素,其原子序数依次增大.A、B可形成A2B和A2B2两种化合物,B、C同主族且可形成CB2和CB3两种化合物.回答下列问题.
有A、B、C、D四种短周期元素,其原子序数依次增大.A、B可形成A2B和A2B2两种化合物,B、C同主族且可形成CB2和CB3两种化合物.回答下列问题.