
| 选项 | 被提纯的物质 | 除杂试剂 | 分离方法 |
| A | 乙酸乙酯(乙酸) | CCl4 | 萃取、分液 |
| B | 苯(苯酚) | 浓溴水 | 过滤 |
| C | 乙烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| D | 溴苯(溴) | 氢氧化钠溶液 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:选择题
| A. | 属于置换反应 | B. | A1作还原剂 | ||
| C. | Fe2O3被还原 | D. | 该反应是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 阳离子 | K+ Cu2+ Fe3+ Al3+ Fe2+ |
| 阴离子 | Cl- CO32- NO3- SO42- SiO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述反应中氮气作还原剂 | |
| B. | 氮氧化铝中氮元素的化合价是-3 | |
| C. | 氮氧化铝晶体中的作用力是范德华力 | |
| D. | 根据氮氧化铝晶体的硬度可推断其晶体类型可能与石英相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
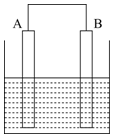
| A. | 导线中有电子流动,电流方向为A流向B | |
| B. | 溶液中的O2在电极B得电子,电极B附近碱性增强 | |
| C. | 电极A上的电极反应式为Fe-2e-=Fe2+ | |
| D. | 溶液中的Na+向电极B附近移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 共价键 | C-H | H-H | C≡C |
| 键能/kJ•mol-1 | 413.4 | 436 | 812 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | Ⅰ和Ⅱ中正级均被保护 | |
| B. | Ⅰ和Ⅱ中负极反应均是Fe-2e-=Fe2+ | |
| C. | Ⅰ和Ⅱ中正级反应均是O2+2H2O+4e-=4OH- | |
| D. | Ⅰ和Ⅱ中均有Fe2+生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com