
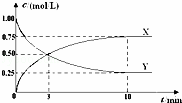
将CO2转化为甲醇的原理为 CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H<0.500℃时,在体积为1L 的固定容积的密闭容器中充入1mol CO2、3mol H2,测得CO2浓度与CH3OH 浓度随时间的变化如图所示,从中得出的结论错误的是( )
|
| A. | 曲线X可以表示CH3OH(g) 或H2O(g) 的浓度变化 |
|
| B. | 从反应开始到10min时,H2的反应速率v(H2)=0.225mol/(L﹒min) |
|
| C. | 平衡时H2 的转化率为75% |
|
| D. | 500℃时该反应的平衡常数K=3 |
| 物质的量或浓度随时间的变化曲线.. | |
| 专题: | 化学平衡专题. |
| 分析: | A.随反应进行X的浓度增大,X表示生成物,由方程式可知CH3OH(g)、H2O(g)的浓度变化相等; B.Y的起始浓度为1mol/L,故Y表示二氧化碳,根据v= C.根据二氧化碳的浓度变化计算氢气的浓度变化,氢气的转化率= D.利用三段式计算平衡常数各组分的平衡浓度,代入平衡常数表达式计算. |
| 解答: | 解:A.随反应进行X的浓度增大,X表示生成物,由方程式可知CH3OH(g)、H2O(g)的浓度变化相等,曲线X可以表示CH3OH(g) 或H2O(g) 的浓度变化,故A正确; B.Y的起始浓度为1mol/L,故Y表示二氧化碳,平衡时二氧化碳的浓度为0.25mol/L,故v(CO2)= C.平衡时二氧化碳的浓度为0.25mol/L,二氧化碳的浓度变化量为1mol/L﹣0.25mol/L=0.75mol/L,由方程式可知氢气的浓度变化为3×0.75mol/L=2.25mol/L,氢气的转化率= D.平衡时二氧化碳的浓度为0.25mol/L,则: CO2(g)+3H2(g) 开始(mol/L):1 3 0 0 变化(mol/L):0.75 2.25 0.75 0.75 平衡(mol/L):0.25 0.75 0.75 0.75 故平衡常数k= 故选D. |
| 点评: | 本题考查化学图象问题,涉及化学反应速率、化学平衡、平衡常数计算等,题目难度中等,注意根据图象计算各物质的平衡浓度为解答该题的关键. |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
植物油厂为了提取大豆中丰富的油脂,下列方案设计合理的是( )
A.将大豆用水浸泡,使其中的油脂溶于水,然后再分馏
B.先将大豆压成颗粒状,再用无毒的有机溶剂浸泡,然后对浸出液进行蒸馏分离
C.将大豆用碱溶液处理,使其中的油脂溶解下来,然后再蒸发
D.将大豆粉碎,然后隔绝空气加热,使其中的油脂挥发出来
查看答案和解析>>
科目:高中化学 来源: 题型:
50 g浓度为c mol·L-1,密度为ρ g·cm-3的氨水中加入一定量的水稀释成0.5c mol·L-1,则加入水的体积为( )
A.小于50 mL B.等于50 mL
C.大于50 mL D.等于50/ρ mL
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室保存下列试剂的方法不正确的是( )
|
| A. | 钠保存在煤油中 |
|
| B. | 用棕色试剂瓶盛放新制的氯 |
|
| C. | 用带玻璃塞的试剂瓶盛放NaOH溶液 |
|
| D. | 向盛放氯化亚铁溶液的试剂瓶中加少量铁粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是( )
|
| A. | 钠和冷水反应:Na+2H2O=Na++2OH﹣+H2↑ |
|
| B. | AlCl3溶液中加入过量的浓氨水:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ |
|
| C. | 用小苏打治疗胃酸过多:CO32﹣+2H+=H2O+CO2↑ |
|
| D. | 用FeCl3溶液腐蚀印刷电路板:Fe3++Cu=Fe2++Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙两同学研究Na2SO3溶液与FeCl3溶液反应的情况.
| 步骤 | 操作 | 现象 |
| I | 向2mL 1mol•L﹣1FeCl3溶液中加入一定量的Na2SO3溶液 | 溶液由棕黄色变为红褐色, 并有少量刺激性气味的气体逸出 |
(1)常温下,FeCl3溶液的pH 7(填“<”、“>”或“=”).
(2)分析红褐色产生的原因.
①甲同学认为步骤I中溶液呈红褐色是因为生成了Fe(OH)3,用化学平衡移动原理解释溶液呈红褐色的原因: .
②乙同学认为可能是发生了氧化还原反应,完成并配平其反应的离子方程式:
□Fe3++□SO32﹣+□ ═□Fe2+□ +□
乙同学查阅资料得知:
| 1.Fe2+与SO32﹣反应生成墨绿色的絮状沉淀FeSO3; 2.墨绿色的FeSO3与黄色的FeCl3溶液混合后,溶液呈红褐色. |
(3)甲同学为了确认溶液呈红褐色的原因是生成了Fe(OH)3,设计并完成如下实验:
| 步骤 | 操作 | 现象 |
| Ⅱ | 用激光笔照射步骤I中的红褐色溶液 | 出现“丁达尔效应” |
甲同学因此得出结论:溶液呈红褐色是因为生成了Fe(OH)3.而乙同学认为甲同学得出结论的证据仍然不足,乙同学的理由是 .
(4)进一步确认Na2SO3溶液与FeCl3溶液反应的情况,乙同学设计并完成如下实验:
| 步骤 | 操作 | 现象 |
| Ⅲ | 向1mol•L﹣1的FeCl3溶液中通入一定量的SO2 | 溶液由黄色变为红褐色 |
| Ⅳ | 用激光笔照射步骤Ⅲ中的红褐色溶液 | 没有出现“丁达尔效应” |
①经检验步骤III中红褐色溶液含有Fe2+,检验Fe2+选用的试剂是 (填字母).
a.K3[Fe(CN)6]溶液 b.KSCN溶液 c.KMnO4溶液
②已知H2SO3是弱酸,请结合电离方程式说明步骤Ⅲ中出现红褐色的原因: .
(5)结论:由上述实验得知,甲、乙两同学所持观点均正确.
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3。Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用。某科研小组用该原理处理污水,设计的装置如图所示。下列说法正确的是( )
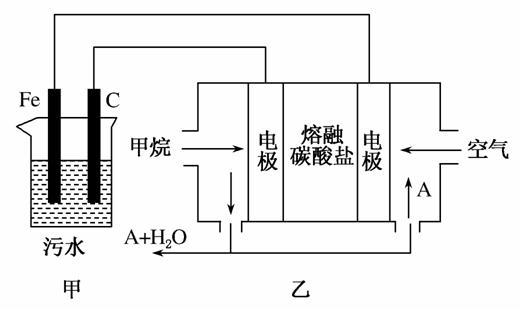
A.为了增加污水的导电能力,应向污水中加入适量的H2SO4溶液
B.甲装置中Fe电极的反应为Fe-3e-===Fe3+
C.为了使燃料电池乙长时间稳定运行,电池的电解质组成应保持稳定,电池工作时,循环的物质A为CO2
D.当乙装置中有1.6 g CH4参加反应时,C电极理论上生成气体的体积在标准状况下为4.48 L
查看答案和解析>>
科目:高中化学 来源: 题型:
应用所学知识回答下列问题:
(1)下列叙述中,正确的是________。
A.蚕丝、棉花和羊毛的主要成分都是纤维素
B.我们所吃的豆腐中主要含有蛋白质
C.“非典”元凶冠状病毒是一种油脂
D.生物实验室用福尔马林(40%的甲醛溶液)保存生物标本
(2)蛋白质水解的最终产物是________。
(3)下列有关说法正确的是________。
A.蛋白质中只含C、H、O三种元素
B.油脂在人体中发生水解的产物是氨基酸
C.糖类并不都有甜味
D.糖类、油脂、蛋白质都能发生水解反应
(4)淀粉溶液和蛋白质溶液都是胶体,用一束光通过其溶液,都产生________现象,若检验它们可选用的试剂是________。
(5)血液中有一种含铜的呈蓝色的蛋白质分子,其相对分子质量约为151 000。已知该分子中铜的质量分数为0.34%,则平均每个铜蓝蛋白质分子中的铜原子数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁的快速发展方便了人们的出行。工业上利用铝热反应焊接钢轨间的缝隙,反应方程式如下:
2Al+Fe2O3 2Fe+Al2O3,其中Fe2O3是
2Fe+Al2O3,其中Fe2O3是
A.氧化剂 B.还原剂 C.既是氧化剂又是还原剂 D.既不是氧化剂又不是还原剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com