
| A. | 漂白粉的有效成分是Ca(ClO)2,应密封保存 | |
| B. | 紫色石蕊试液中通入过量二氧化硫气体,溶液将先变红后褪色 | |
| C. | 加热NH4Cl晶体时,用湿润的红色石蕊试纸靠近试管口,检验NH3的生成 | |
| D. | 将SO2通入BaCl2溶液可生成BaSO3沉淀 |
分析 A.氯气与石灰乳制备漂白粉,漂白粉与空气中的水、二氧化碳反应生成HClO,HClO光照分解;
B.二氧化硫为酸性氧化物;
C.加热NH4Cl晶体时,分解生成氨气和HCl,在试管口又化合生成氯化铵;
D.盐酸的酸性大于亚硫酸的酸性,SO2通入BaCl2溶液中不反应.
解答 解:A.氯气与石灰乳制备漂白粉,生成的次氯酸钙具有强氧化性,则漂白粉的有效成分是Ca(ClO)2,漂白粉与空气中的水、二氧化碳反应生成HClO,HClO光照分解,可知应密封保存,故A正确;
B.二氧化硫为酸性氧化物,则紫色石蕊试液中通入过量二氧化硫气体,溶液将变红,故B错误;
C.加热NH4Cl晶体时,分解生成氨气和HCl,在试管口又化合生成氯化铵,则用湿润的红色石蕊试纸靠近试管口,不能检验NH3的生成,故C错误;
D.盐酸的酸性大于亚硫酸的酸性,SO2通入BaCl2溶液中不反应,无现象,不能生成沉淀,故D错误;
故选A.
点评 本题考查物质的性质,为高频考点,把握物质的性质、发生的反应、反应与现象的关系为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 使用铁触媒,加快合成氨反应速率 | B. | 过量空气有利于SO2转化为SO3 | ||
| C. | 打开汽水瓶盖,即有大量气泡逸出 | D. | 配置FeCl3溶液时,加入少量盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,A或B可以与水发生反应 | |
| B. | A与B用导线连接插入稀HNO3中,则形成原电池且B极上有H2放出 | |
| C. | A与B用导线连接插入B(NO3)2中,B极发生的电极反应式可能为:B2++2e-═B | |
| D. | 电解A(NO3)2与B(NO3)2的混合液,在阳极先析出B(使用碳电极) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 我国“西气东输”中的“气”指的是石油气 | |
| B. | 废弃物在一定条件下发生化学反应,产生热值较高的可燃性气体,该过程属于生物化学转化 | |
| C. | 煤干馏的主要产物为焦炭、煤焦油、粗氨水和焦炉气 | |
| D. | 石油分馏是化学变化,可得到汽油、煤油等产品 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中所含的离子是:Fe2+?Na+?SO42-?NO3-? | |
| B. | 若向该溶液中加入过量的稀硫酸,产生的气体在空气中能变成红棕色 | |
| C. | 若向该溶液中加入过量的稀硫酸和KSCN溶液,溶液显血红色 | |
| D. | 若向该溶液中加入足量的NaOH 溶液,充分反应后,过滤?洗涤?灼烧,最终所得固体的质量为72g |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
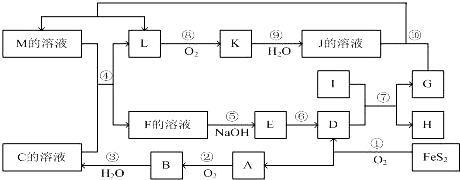
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸的氢离子浓度大于盐酸 | |
| B. | pH值越大,酸性越强 | |
| C. | pH=7的溶液一定呈中性 | |
| D. | 酸性溶液中氢离子浓度一定大于氢氧根离子浓度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com