
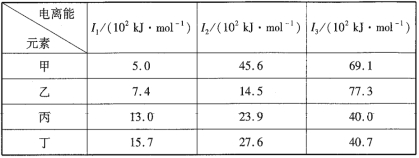
【题目】下表是第三周期部分元素的电离能数据,下列说法正确的是( )
A.甲的金属性比乙弱B.乙的最高正化合价为+1
C.丙一定为非金属元素D.丁一定是金属元素
【答案】C
【解析】
甲、乙、丙、丁为第三周期元素,甲元素的第一电离能远远小于第二电离能,说明A元素最外层有1个电子,失去1个电子时达到稳定结构,所以甲为Na元素;乙元素的第二电离能远远小于第三电离能,则乙元素最外层有2个电子,失去两个电子后达到稳定结构,所以乙为Mg元素;丙、丁元素的第一电离、第二电离能、第三电离能相差不大,说明丙元素最外层电子数大于3,则丙、丁一定为非金属元素。
A. 甲为Na元素,乙为Mg元素,则甲的金属性比乙强,故A错误;
B. 乙为Mg元素,化合价为+2价,故B错误;
C. 丙元素的第一电离、第二电离能、第三电离能相差不大,说明丙元素最外层电子数大于3,则丙一定为非金属元素,故C正确;
D.丁元素的第一电离、第二电离能、第三电离能相差不大,说明丙元素最外层电子数大于3,则丁一定为非金属元素,不可能是金属元素,故D错误;
故选C。


 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:
【题目】二氧化硫分子(SO2)分子中共有__个σ键,其中心原子(硫原子)的孤电子对数为__;价层电子对数为__,该分子的VSEPR模型为__;则该分子呈__形,二氧化硫分子的中心原子的杂化类型为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是某兴趣小组根据教材实验设计的一个能说明碳酸钠与碳酸氢钠热稳定性的套管实验。请观察如下图所示实验装置,分析实验原理,并判断下列说法和做法,其中不科学的是( )

A. 甲为小苏打,乙为纯碱
B. 要证明碳酸氢钠受热能产生水,可在小试管内塞上沾有无水硫酸铜粉末的棉花球
C. 加热不久就能看到A烧杯的澄清石灰水变浑浊
D. 整个实验过程中都没有发现A烧杯的澄清石灰水变浑浊
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的Cl 2 通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO- 和ClO3-两种离子的物质的量( n )与反应时间( t )的变化示意图如图所示。 下列说法正确的是( )
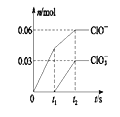
A. 苛性钾溶液中KOH的物质的量为0.18mol
B. 反应中转移电子的物质的量是0.09 mol
C. 在酸性条件下ClO- 和ClO3-能反应得到氯气
D. ClO3-的生成可能是由于温度升高引起的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据图中相关信息,判断下列说法正确的是( )
A.在NaCl晶体中,距离Na+最近的Cl-形成正四面体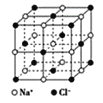
B.该气态团簇分子的分子式为E4F4或F4E4
C.CO2晶胞中每个分子周围有8个紧邻的CO2分子
D.在碘晶体中,碘分子的排列有4种不同的方向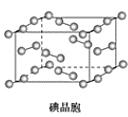
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组请你参与“铁及其化合物”有关性质的实验探究,并共同解答下列问题:
探究一
(1)将FeCl3溶液滴入沸水可以制得Fe(OH)3胶体,写出其离子反应__。
(2)电子工业用FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式__。
工程师欲从制造印刷电路板的废水中回收铜,并获得FeCl3溶液,设计如下方案:
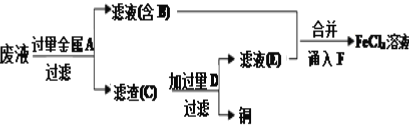
根据上述设计方案并结合所学知识回答以下问题。
(3)检验滤液E中金属阳离子的方法是__。
(4)通入F发生反应的离子方程式为__。
探究二
FeBr2是一种黄绿色鳞片状的固体,某研究性小组需要90mL0.10mol·L-1FeBr2溶液,回答下列问题:
(1)配制FeBr2溶液除烧杯、量筒、玻璃棒、胶头滴管外还需的玻璃仪器是__。
(2)用托盘天平称量FeBr2的质量为__g。
(3)下列有关配制过程中说法正确的是__(填序号)。
a.用“左码右物”的称量方法称量固体质量(使用游码)会偏大
b.将称量的FeBr2放入容量瓶中,加90mL蒸馏水溶解
C.洗涤溶解FeBr2的烧杯,并将洗涤液转移至容量瓶中
d.容量瓶贴签存放配好的FeBr2溶液
e.定容时,仰视容量瓶刻度线会使配制的FeBr2溶液浓度偏高
探究三
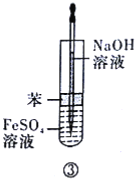
制备Fe(OH)2,在如图所示的装置中,用NaOH溶液、铁屑、稀H2SO4等试剂来制备。
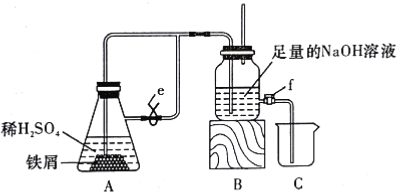
(1)实验开始时(活塞f关闭),止水夹e是__(填“打开”或“关闭”)的。
(2)如何检验装置内空气已经排尽?__。
(3)排尽装置内空气后,为了制得白色Fe(OH)2沉淀,操作步骤是__。
(4)开启活塞f放掉约![]() 液体,此时裝置B中试剂瓶中发生的化学反应方程式为__。
液体,此时裝置B中试剂瓶中发生的化学反应方程式为__。
(5)下列各图示中__(填序号)能较长时间看到Fe(OH)2白色沉淀。
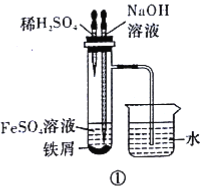
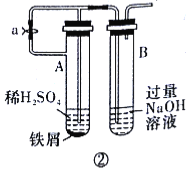
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA是阿伏加德罗常数的值,下列说法错误的是( )
A.3 g 3He含有的中子数为1NA
B.1 L 0.1 mol·L1磷酸钠溶液含有的![]() 数目为0.1NA
数目为0.1NA
C.1 mol K2Cr2O7被还原为Cr3+转移的电子数为6NA
D.常温下,11g CO2所含的共用电子对数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某化合物的晶体是由如图所示的最小结构单元密置堆积而成,下列关于该化合物叙述错误的是( )
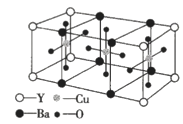
A.该化合物的化学式是YBa2Cu3O6
B.1mol该化合物中含有1molY
C.1mol该化合物中含有3molCu
D.1mol该化合物中含有2molBa
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组探究AgNO3溶液与Na2SO3溶液的反应。
实验I | 操作 | 现象 |
| 滴加5滴0.1mol/L Na2SO3溶液,振荡 | 产生白色沉淀,测得混合溶液pH=5 |
继续滴加0.1mol/L Na2SO3溶液,振荡 | 白色沉淀增多,继续滴加,白色沉淀消失,测得混合溶液pH=9 |
资料:Ag2SO3,白色固体,难溶于水;Ag2SO4,白色固体,微溶于水;AgOH,白色固体,常温下不稳定,易分解产生棕褐色固体。
(1)测得0.1mol/L Na2SO3溶液pH=10,用离子方程式解释原因:_______。
(2)实验小组对白色沉淀的成分提出猜想:
①可能含Ag2SO3。
②可能含Ag2SO4,理由是________。
③可能含AgOH。
实验产生的白色沉淀放置一段时间后未发生明显变化,排除猜想③。
(3)检验白色沉淀的成分
(资料:Ag++2S2O32![]() Ag(S2O3)23,Ag(S2O3)23在溶液中稳定存在。)
Ag(S2O3)23,Ag(S2O3)23在溶液中稳定存在。)
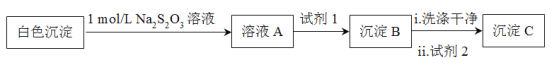
测得沉淀C质量小于沉淀B,试剂1和试剂2分别是_____、______,说明白色沉淀是Ag2SO3和Ag2SO4的混合物。
(4)探究白色沉淀消失的原因。实验小组设计对照实验:
实验II | 实验III | |
实验操作 |
|
|
现象 | 沉淀溶解 |
① 补充实验III的实验操作及现象:_______,证明SO32使白色沉淀溶解。
② 查阅资料:Ag2SO3能溶于过量Na2SO3溶液中形成Ag(SO3)23。白色沉淀中含有g2SO4,但还能全部溶解于Na2SO3溶液的原因是______。
(5)探究AgNO3溶液与Na2SO3溶液能否发生氧化还原反应。
实验IV | 操作 | 现象 |
| 步骤i:滴加一定体积0.1 mol/L Na2SO3溶液 | 产生白色沉淀 |
步骤ii:再加入NaOH溶液调pH=14,振荡 | 白色沉淀变黑,经检验为Ag |
步骤ii中Ag2SO3发生反应的离子方程式是_________。
(6)综合实验I和IV,说明AgNO3溶液与Na2SO3溶液的反应类型与_______有关。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com