
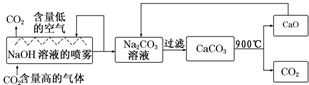
分析 (1)反应物接触面积越大,反应速率越快;
(2)n(NaOH)=1.0mol/L×0.8=0.8mol,n(CO2)=$\frac{11.2L}{22.4L/mol}$=0.5mol,1<$\frac{n(NaOH)}{n(C{O}_{2})}$<2,根据原子守恒确定产物及其物质的量之间的关系;根据原子守恒和物料守恒计算;
(3)根据盖斯定律及已知热化学方程式计算;
(4)A.无论反应是否达到平衡状态,n(CH3OH):n(H2O)为1:1;
B.当反应前后改变的物理量不变时,该反应达到平衡状态;
C.△H<0,升高温度,平衡逆向移动;
D.保持温度不变,当反应已达平衡时,若向容器中再充入1mol CO2和3mol H2,相当于增大压强,平衡向气体体积减小的方向移动.
解答 解:(1)反应物接触面积越大,反应速率越快,则NaOH溶液喷成雾状的目的是为了增大气液反应物的接触面积,既加速反应又提高CO2的吸收率,
故答案为:增大气液反应物的接触面积,既加速反应又提高CO2的吸收率;
(2)n(NaOH)=1.0mol/L×0.8=0.8mol,n(CO2)=$\frac{11.2L}{22.4L/mol}$=0.5mol,1<$\frac{n(NaOH)}{n(C{O}_{2})}$<2,
设n(Na2CO3)为x,n(NaHCO3)为y,根据原子守恒得:2x+y=0.8、x+y=0.5,解得:x=0.3、y=0.2,所以该反应方程式为:5CO2+8OH-=2HCO3-+3CO32-+3H2O,根据物料守恒得n(Na+)=0.8mol,n(CO32-)+n(H2CO3)+n(HCO3-)=0.5mol,
根据电荷守恒得n(Na+)+n(H+)=2n(CO32-)+n(OH-)+n(HCO3-),所以得n(CO32-)-n(H2CO3)-n(H+)+n(OH-)=0.3 mol,
故答案为:5CO2+8OH-=2HCO3-+3CO32-+3H2O;n(CO32-)-n(H2CO3)-n(H+)+n(OH-);
(3)①2NH3(g)+CO2(g)=NH2CO2NH4(s)△H=-159.47kJ•mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)△H=+116.49kJ•mol-1
③H2O(l)=H2O(g)△H=+88.0kJ•mol-1
由盖斯定律计算①+②-③得:2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=-130.98 kJ•mol-1,
故答案为:2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=-130.98 kJ•mol-1;
(4)A.若保持恒温,无论该反应是否达到平衡状态,容器中n(CH3OH):n(H2O)始终为1:1,所以不能据此判断平衡状态,故A错误;
B.该反应是反应气体体积减小的反应,若保持恒温,当容器内气体压强恒定时,该反应已达平衡状态,故正确;
C.该反应为放热反应,温度升高平衡逆向移动,反应物浓度增大,产物浓度减小,平衡常数减小,故C错误;
D.可将1mol CO2和3mol H2看成先充入另一个相同容器中,达到平衡时状态完全相同,然后加压将两个容器中的气体合并到一个容器中,根据化学平衡移动原理可知,平衡将正向移动,CH3OH的物质的量增大,H2的物质的量减小,n(CH3OH):n(H2)的比值增大,故D正确;
故答案为:BD.
点评 本题考查了氧化还原反应、盖斯定律、化学平衡等知识,为高考热点,题目难度中等,根据氧化还原反应实质、盖斯定律内涵、化学平衡的判断方法等知识点来分析解答,注意结合守恒思想进行分析.


科目:高中化学 来源: 题型:选择题
| A. | 10℃时,粉末状锌与3 mol/L硫酸溶液反应 | |
| B. | 50℃时,粉末状锌与3 mol/L硫酸溶液反应 | |
| C. | 10℃时,块状锌与3 mol/L硫酸溶液反应 | |
| D. | 50℃时,块状锌与3 mol/L硫酸溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
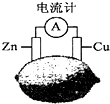
| A. | 将电能转换为化学能 | B. | 电子由铜片流出经导线到锌 | ||
| C. | 一段时间后,锌片质量减轻 | D. | 铜片一侧柠檬变蓝色,产生Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 推广使用无磷洗衣粉主要是为了防止水体富营养化 | |
| B. | 高铁酸钾(K2FeO4)是一种新型自来水处理剂,有强氧化性可消毒杀菌,其还原产物能吸附水中杂质 | |
| C. | 石油裂解、煤的气化、海水制镁、纤维素制火棉等过程中都包含化学变化 | |
| D. | 测定有机物结构方法较多,如红外光谱、紫外光谱、质谱、核磁共振氢谱、同位素原子示踪法等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中性溶液中:Fe3+、K+、Cl-、SO42- | |
| B. | 在澄清透明溶液中:NH4+、Cu2+、Cl-、SO42- | |
| C. | 酸性溶液中:Na+、K+、ClO-、NO3- | |
| D. | 0.1 mol•L-1 KMnO4溶液:Na+、K+、Cl-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | … | 23 | 24 |
| C2H6 | C2H6O | C2H4O2 | C3H8 | C3H8O | C3H6O2 | C4H10 | … | M | N |
| A. | M为C9H20O | B. | N为C9H18O2 | ||
| C. | M、N均可发生加成反应 | D. | M、N均可能发生取代反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com