
| 编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
| 名称 | 酒精 | 醋酸 | 火碱 | 食盐 | 铜导线 | 亚硫酸酐 | 苏打 |
| 主要成分 | CH3CH2OH | CH3COOH | NaOH | NaCl | Cu | SO2 | Na2CO3 |
分析 (1)能电离出金属阳离子(或铵根离子)和酸根离子的化合物属于盐,在水溶液或熔融状态下能导电的化合物叫电解质,在水溶液和熔融状态下均不能导电的化合物叫非电解质;
(2)根据物质的性质书写化学方程式或离子方程式;
(3)在Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O反应中,Cu化合价升高,由0价升高到+2价,S元素化合价降低,由+6价降低到+4价;根据方程式每反应1mol铜转移2mol电子;
(4)根据定容的操作方法结合c=$\frac{n}{V}$分析操作对溶质的物质的量或对溶液的体积的影响判断,根据m=nM=cVM来计算质量.
解答 解:(1)②③④⑦是在水溶液状态下均能导电的化合物,属于电解质,①⑥是在水溶液和熔融状态下均不能导电的化合物,属于非电解质,
故答案为:②③④⑦;①⑥;
(2)CH3COOH和碳酸钠反应生成醋酸钠和二氧化碳,方程式为2CH3COOH+Na2CO3=2CH3COONa+CO2↑+H2O,即2CH3COOH+CO32-=2CH3COO-+CO2↑+H2O,故答案为:2CH3COOH+CO32-=2CH3COO-+CO2↑+H2O;
(3)①铜失电子数=1(2-0)=2,硫酸得电子数=1(6-4)=2,该反应中转移电子数是2,用用双线桥标出该反应电子转移的方向和数目为: ,故答案为:
,故答案为: ;
;
②Cu化合价升高,由0价升高到+2价,S元素化合价降低,由+6价降低到+4价;根据方程式,被氧化的硫酸是1mol,未被氧化的H2SO4的物质的量是1mol,二者物质的量之比为1:1,每反应1mol铜转移2mol电子,当电子转移0.1mol时,反应的铜为0.05mol,质量为3.2g,故答案为:1:1;3.2;
(4)定容时眼睛与刻度线相平,不能俯视或仰视;定容时,眼睛仰视刻度线,溶液的液面超过刻度线,溶液的体积偏大,浓度偏小,配制480mL0.5mol/L的NaOH溶液应称取NaOH的质量是0.5L×0.5mol/L×40g/mol=10.0g,
故答案为:C; 偏低;10.0.
点评 本题考查较为综合,涉及物质的分类和氧化还原反应等知识,题目难度不大,明确元素化合价变化是解本题关键,难点是标电子转移的方向和数目,注意箭头的指向.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe+2HCl═FeCl2+H2↑ | |
| B. | 2HCl+Ca(ClO)2═2HClO+CaCl2 | |
| C. | I2+2NaClO3═2NaIO3+Cl2↑ | |
| D. | 4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
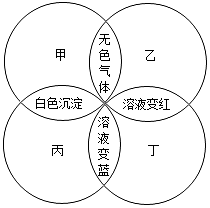 甲、乙、丙、丁分别是石蕊溶液、稀硫酸、碳酸钠溶液、澄清石灰水中的一种,若用四个圆表示四种溶液,两圆相交部分为两溶液混合后出现的主要实验现象,如图所示.请回答:
甲、乙、丙、丁分别是石蕊溶液、稀硫酸、碳酸钠溶液、澄清石灰水中的一种,若用四个圆表示四种溶液,两圆相交部分为两溶液混合后出现的主要实验现象,如图所示.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
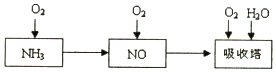
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com