
| A. | 两者都可以和NaOH溶液反应 | B. | 可利用水将两者区分开 | ||
| C. | 两者互为同分异构体 | D. | 两者互为同系物 |
科目:高中化学 来源: 题型:选择题
| A. | 消耗2 mol SO2的同时生成1 mol O2 | |
| B. | 容器内气体总物质的量不再变化 | |
| C. | 反应平衡常数保持不变 | |
| D. | SO3的气体体积分数不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气的燃烧热为285.8kJ/mol,则氢气燃烧的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ/mol | |
| B. | 等质量的硫蒸气和硫磺分别完全燃烧,二者放出的热量一样多 | |
| C. | 已知中和热为57.3 kJ/mol,若将含0.5molH2SO4的浓溶液与含1molNaOH的溶液混合,放出的热量等于57.3kJ | |
| D. | 2H2(g)+O2(g)═2H2O(l)△H=-Q1 kJ/mol 2H2(g)+O2(g)═2H2O(g)△H=-Q2 kJ/mol,则Q1>Q2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
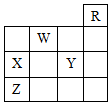
| A. | 五种元素中,只有Z为金属元素 | |
| B. | W位于ⅥA族,有+6、-2两种常见化合价 | |
| C. | X和Y的最高价氧化物对应水化物都是强酸 | |
| D. | X、Y、Z的气态氢化物的稳定性:Y>X>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 44 g乙醛中所含的氧原子数为NA | |
| B. | 常温常压下,8gCH4含有5 NA个电子 | |
| C. | 标准状况下,22.4L苯含有NA个C6H6分子 | |
| D. | 14 g乙烯中所含的C-H键数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO4溶液中加Ba(OH)2溶液至中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| B. | 往NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH-═NH3↑+H2O | |
| C. | 往醋酸酸化的碘化钾溶液中滴加适量的双氧水:2I-+2H++H2O2═I2+2H2O | |
| D. | 氢硫酸里通入氯气:H2S+Cl2═2H++S↓+2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示装置中,观察到电流计指针偏转;M棒变粗;N棒变细.由此判断表中所列M、N、P物质,其中可以成立的是( )
如图所示装置中,观察到电流计指针偏转;M棒变粗;N棒变细.由此判断表中所列M、N、P物质,其中可以成立的是( )| M | N | P | |
| A | Zn | Cu | 稀H2SO4溶液 |
| B | Cu | Fe | 稀HCl溶液 |
| C | Ag | Zn | AgNO3溶液 |
| D | Zn | Fe | CuSO4溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com