
| A. | 小于0 | B. | 等于0 | C. | 大于0 | D. | 不能确定 |
科目:高中化学 来源: 题型:解答题
 化学反应与能量有着密不可分的关系,回答下列问题.
化学反应与能量有着密不可分的关系,回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室用碱石灰吸收SO2 | B. | CO2与澄清石灰水作用 | ||
| C. | N2O5与水反应制备HNO3 | D. | Na2O2与水反应制备氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸铜溶液与氢氧化钡溶液混合:Cu2++2 OH-=Cu(OH)2↓ | |
| B. | 用小苏打(NaHCO3)治疗胃酸(主要成分是盐酸)过多:CO32-+H+═CO2↑+H2O | |
| C. | 将少量二氧化碳气体通入澄清石灰水中:2OH-+CO2═CO32-+H2O | |
| D. | 稀硫酸与氢氧化钡溶液混合:2H++SO42-+Ba2++2OH-=2H2O+BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸 | H2CO3 | 水杨酸( ) ) |
| 电离平衡常数(925℃) | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka1=1.3×10-3 Ka2=1.1×10-11 |
| A. | 常温下,等浓度、等体积的NaHCO3溶液pH小于 溶液pH 溶液pH | |
| B. | 常温下,等浓度、等体积的Na2CO3溶液和  溶液中所含离子总数前者小于后者 溶液中所含离子总数前者小于后者 | |
| C. | 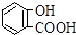 +2NaHCO3→ +2NaHCO3→ +2H2O+2CO2↑ +2H2O+2CO2↑ | |
| D. | 水杨酸的第二级电离 Ka2 远小于第一级电离Ka1的原因之一是能形成分子内氢键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com