
| A.10 | B.50 | C.5×103 | D.104 |
 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化学 来源:不详 题型:单选题
 的稀溶液中
的稀溶液中 已知
已知 向该溶液中逐滴加入PH=c的盐液,测得混合溶液的部分PH如下表所示
向该溶液中逐滴加入PH=c的盐液,测得混合溶液的部分PH如下表所示| |  溶液体积/ml 溶液体积/ml | 盐液的体积/ml | 溶液的PH |
| ① | 22.00 | 0.00 | 8 |
| ② | 22.00 | 18.00 | 7 |
| ③ | 22.00 | 22.00 | 6 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.大豆 | B.甜菜 | C.茶叶 | D.西瓜 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.煤的干馏是将煤隔绝空气加强热使之分解的过程 |
| B.煤的气化是将其通过物理变化转化为气态的过程 |
| C.天然气除了作燃料之外,还可用于合成氨和生产甲醇 |
| D.石油分馏按碳原子数递增的顺序可得到液化石油气、汽油、煤油、柴油、沥青等产品。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1:9 | B.1:11 | C.9:1 | D.11:1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.95℃纯水的pH<7,说明加热可导致水呈酸性 |
| B.pH=3的醋酸溶液,稀释至10倍后pH=4 |
| C.0.2 mol?L-1的盐酸,与等体积水混合后pH=1 |
| D.pH=3的醋酸溶液,与pH=11的氢氧化钠溶液等体积混合后pH=7 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
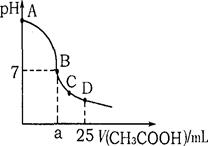
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.无论是纯水,还是酸性、碱性或中性稀溶液,在常温下,其c(H+)×c(OH-)=1×10-14 |
| B.c(H+)等于1×10-7 mol/L的溶液一定是中性溶液 |
| C.0.2 mol/L CH3COOH溶液中的c(H+)是0.1 mol/L CH3COOH溶液中的c(H+)的2倍 |
| D.强电解质的水溶液中不存在电解质分子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com