
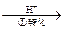 Cr2O72-
Cr2O72- Cr3+
Cr3+ Cr(OH)3↓
Cr(OH)3↓ Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O 。
。 7H2O。
7H2O。 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:填空题
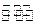 CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2> t1):
CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2> t1):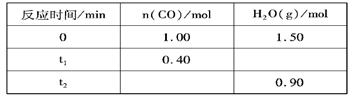
 保持其他条件不变,在t2时向容器中再通人0.50molCO,与原平衡相比,达到新平衡时CO转化率将________________(填增大或减小,下同),H2O的体积分数将 ______ 。
保持其他条件不变,在t2时向容器中再通人0.50molCO,与原平衡相比,达到新平衡时CO转化率将________________(填增大或减小,下同),H2O的体积分数将 ______ 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.平衡常数随温度的改变而改变 |
B.对于密闭容器中反应2SO2+O2 2SO3,2体积SO2与足量O2反应,能生成2体积SO3 2SO3,2体积SO2与足量O2反应,能生成2体积SO3 |
| C.合成氨反应中使用催化剂,降低了反应所需要的活化能。 |
D.反应H2(g)+I2(g)  2HI(g) 在450℃时,其平衡常数为49;则反应 2HI(g) 在450℃时,其平衡常数为49;则反应 |
 1 ∕ 2 H2(g) +1 ∕ 2 I2(g) 在450℃时的平衡常数为1 ∕ 7
1 ∕ 2 H2(g) +1 ∕ 2 I2(g) 在450℃时的平衡常数为1 ∕ 7查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2B(g)+E(g)(正反应为吸热反应)达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是
2B(g)+E(g)(正反应为吸热反应)达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是| A.降温 | B.减压 | C.减少E的浓度 | D.加压 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 b Z(g),反应达到平衡后,测得X的转化率为50% 。而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度的3/4,则a和b的数值可能是
b Z(g),反应达到平衡后,测得X的转化率为50% 。而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度的3/4,则a和b的数值可能是| A.a="l" ,b="l" | B.a="2" ,b="1" | C.a="2" ,b="2" | D.a="3" ,b=2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.开启啤酒瓶后,瓶中立刻泛起大量泡沫 |
| B.由H2、I2蒸气、HI组成的平衡体系加压后颜色变深 |
| C.向氯水中加CaCO3后,溶液漂白性增强 |
| D.在硫化氢水溶液中加入碱有利于S2- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2Z(g)一定达到化学平衡状态的是( )
2Z(g)一定达到化学平衡状态的是( ) 度不再发生变化
度不再发生变化 | A.①② | B.①④ |
| C.②③ | D.③④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
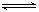 2C(g),10min后达平衡时,在相同温度
2C(g),10min后达平衡时,在相同温度 下测得容器内混合气体的物质的量是反应前的5/6,试计算
下测得容器内混合气体的物质的量是反应前的5/6,试计算查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3OH(g)
CH3OH(g)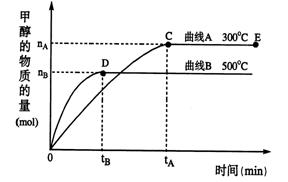
 不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是 。
不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是 。 u2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是: (用化学方程式表示)。
u2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是: (用化学方程式表示)。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com