
| 序号 | HA物质的量浓度(mol?L-1) | NaOH物质的量浓度(mol?L-1) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | H2O2、SO2都能使酸性高锰酸钾褪色 | 两者在反应中均表现还原性 |
| B | 铁比铜活泼 | 铜板上的铁钉在潮湿空气中容易生锈 |
| C | SiO2能与氢氟酸及碱反应 | SiO2是两性氧化物 |
| D | 铁或铝制成的槽车可以密封贮运浓硫酸或浓硝酸 | 铁和铝不能与浓硫酸或浓硝酸反应 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,1 mol氢气中含有NA个氢原子 |
| B、5.6g Fe与足量的盐酸反应转移电子数为0.2NA |
| C、标准状况下,体积2.24L水中含有水分子数为0.1mol |
| D、46g NO2和N2O4的混合物含有分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
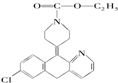 开瑞坦是治疗过敏性鼻炎的良药,其有效成分的结构简式如图所示,下列关于该有机物的说法正确的是( )
开瑞坦是治疗过敏性鼻炎的良药,其有效成分的结构简式如图所示,下列关于该有机物的说法正确的是( )| A、该有机物的分子式是C21H22N2O2Cl |
| B、分子中含有四个六元环,其中有一个是苯环 |
| C、1mol分子发生水解反应后能得到2mol新分子 |
| D、1mol分子发生加成反应需要8molH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
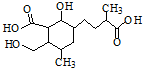 (1)如图有机物的分子式是
(1)如图有机物的分子式是查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com