
| A. | X的氢化物中仅含有极性键 | |
| B. | X与Y形成的三原子分子的电子式是 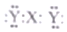 | |
| C. | 原子半径Z>Y,离子半径Z2+<Y2- | |
| D. | X、Y的非金属性强弱可用其氧化物的水化物的酸性强弱来推断 |
分析 短周期主族元素X、Y、Z、W的原子序数依次增大,W的单质是重要的半导体材料,则W为Si元素,X和W同主族,则X为C元素;Y原子的最外层电子数是其内层电子数的3倍,最外层最多含有8个电子,则Y含有2个电子层,最外层含有6个电子,为O元素;Z2+与O2-核外电子排布相同,则Z含有3个电子层,最外层含有2个电子,为Mg元素,据此进行解答.
解答 解:短周期主族元素X、Y、Z、W的原子序数依次增大,W的单质是重要的半导体材料,则W为Si元素,X和W同主族,则X为C元素;Y原子的最外层电子数是其内层电子数的3倍,最外层最多含有8个电子,则Y含有2个电子层,最外层含有6个电子,为O元素;Z2+与O2-核外电子排布相同,则Z含有3个电子层,最外层含有2个电子,为Mg元素,
A.X的氢化物为烃,含有多个C的烃分子中含有C-C非极性键,故A错误;
B.X为C、Y为O,二者形成的化合物为CO2,二氧化碳分子中含有两个碳氧双键,其电子式为 ,故B错误;
,故B错误;
C.Z为Mg、Y为O,电子层越多,粒子半径越大,电子层相同时,核电荷数越大,粒子半径越小,则原子半径Mg>O,离子半径Mg2+<O2-,故C正确;
D.必须是最高价氧化物对应水合物的酸性,没有指出最高价,该说法不合理,故D错误;
故选C.
点评 本题考查原子结构与元素周期律的关系,题目难度不大,推断元素为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的分析能力及逻辑推理能力.


科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 所选主要仪器(铁架台等忽略) | 部分操作 |
| A | 用浓硫酸配制480mL0.1mol/L硫酸溶液 | 500mL容量瓶、烧杯、玻璃棒、量筒、胶头滴管 | 将量取好的浓硫酸放入容量瓶中,加水溶解至刻度线 |
| B | 从食盐水中得到NaCl晶体 | 坩埚、酒精灯、玻璃棒、泥三角、三脚架 | 当加热至大量固体出现时,停止加热,利用余热加热 |
| C | 分离甲醇和甘油的混合物 | 蒸馏烧瓶、酒精灯、温度计、直形冷凝管、锥形瓶、牛角管 | 温度计水银球插入液液面以下 |
| D | 用CCl4萃取溴水中的Br2 | 分液漏斗、烧杯 | 分离时下层液体从分液漏斗下口放出,上层液体从上口倒出 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| Fe3+ | Ni2+ | Cr3+ | |
| 开始沉淀 | 1.5 | 6.7 | 4.0 |
| 沉淀完全 | 3.4 | 9.5 | 6.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )是一种定香剂,以芳香醇A为原料合成H的一种流程如图:
)是一种定香剂,以芳香醇A为原料合成H的一种流程如图:
 +H2O(R1、R表示氢原子或烃基)
+H2O(R1、R表示氢原子或烃基) ;H的官能团名称是碳碳双键、酯基.
;H的官能团名称是碳碳双键、酯基. .
. (写一种即可).
(写一种即可).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCO3-+H2O?H3O++CO32- | B. | HS-+H2O?H2S+OH- | ||
| C. | HSO3-+H2O?SO32-+H3O+ | D. | HCO3-+OH-?H2O+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 金属钠和水反应 | B. | 生石灰变成熟石灰的反应 | ||
| C. | Al和Fe2O3的铝热反应 | D. | CaCO3受热分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12C与14C为不同核素 | B. | 石墨和C60互为同素异形体 | ||
| C. | O2和O3互为同位素 | D. | ${\;}_{17}^{35}$X与${\;}_{17}^{37}$Y 为同种元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.3 mol•L-1•S-1 | B. | 0.4 mol•L-1•S-1 | C. | 0.6mol•L-1•S-1 | D. | 0.8 mol•L-1•S-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com