
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配 料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
分析 (1)依据氧化还原反应的元素化合价变化升低相同,结合质量守恒配平;
(2)①Na2SO3稀溶液与I2反应,Na2SO3被氧化为硫酸钠,I2被还原为I-,结合反应的电荷守恒和原子守恒配平;
溶液呈蓝色,随反应I2+2S2O32-=2I-+S4O62-进行,溶液中没有碘,溶液由蓝色为无色;
②Na2SO3稀溶液与碘的四氯化碳溶液不互溶,分层,要使Na2SO3与碘反应,应充分振荡使其接触;
(3)①溶液呈蓝色,随反应I2+2S2O32-=2I-+S4O62-进行,溶液中没有碘,溶液由蓝色为无色;
②根据(1)中反应方程式计算;
③根据I原子守恒找出碘酸钾中碘原子与碘单质的关系式分析计算.
解答 (1):该反应中化合价的变化为:KIO3→I2,I元素由+5价→0价,一个KIO3分子得5个电子;KI→I2,I元素由-1价→0价,一个KI分子失一个电子,所以得失电子的最小公倍数为5,KIO3的计量数为1,KI的计量数为5,其它元素根据原子守恒配平,所以反应方程式为KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O,
故答案为:1;5;3;3;3;3;
(2)①Na2SO3稀溶液与I2反应,Na2SO3被氧化为硫酸钠,I2被还原为I-,反应的离子方程式是:I2+SO32-+H2O=2I-+SO42-+2H+,
故答案为:I2+SO32-+H2O=2I-+SO42-+2H+;
②Na2SO3稀溶液与碘的四氯化碳溶液不互溶,分层,要使Na2SO3与碘反应,应充分振荡使其接触.所以在步骤b后,增加操作:将分液漏斗充分振荡后静置,
故答案为:在步骤b后,增加操作:将分液漏斗充分振荡后静置;
(3)①碘遇淀粉变蓝色,所以溶液呈蓝色,随反应I2+2S2O32-=2I-+S4O62-进行,溶液中没有碘,溶液由蓝色为无色,说明反应到终点,判断c中反应恰好完全所依据的现象是:滴最后一滴溶液,由蓝色恰好变为无色,且半分钟内不变色,
故答案为:滴最后一滴溶液,由蓝色恰好变为无色,且半分钟内不变色;
②Na2S2O3的物质的量是:2.0×10-3mol/L×0.01L=2.0×10-5mol,根据I2+2S2O32-═2I-+S4O62-可知,b中反应所产生的I2的物质的量是:2.0×10-5mol×$\frac{1}{2}$=1.0×10-5mol,故答案为:1.0×10-5;
③根据KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O可知
I~KIO3~3I2
碘酸钾中的碘 127g 3mol
m 1.0×10-5mol
则:m=$\frac{127}{3}$×10-5g,
所以每千克食盐中含碘质量为:$\frac{1000g}{wg}$×$\frac{127}{3}$×10-5g=$\frac{0.423}{w}$g=$\frac{423}{w}$mg,
则所测精制盐的碘含量是:$\frac{423}{w}$mg/kg,
故答案为:$\frac{423}{w}$.
点评 本题考查了探究物质组成、测量物质含量的方法,题目难度中等,明确实验目的、实验原理为解答关键,试题知识点较多、综合性较强,充分考查学生的分析、理解能力及化学实验能力.


科目:高中化学 来源: 题型:选择题
| A. | CO(g)+2H2(g)═CH3OH(l) | |
| B. | 2Cu(s)+O2(g)═2CuO(s) | |
| C. | NH3(g)+HCl(g)═NH4Cl(s) | |
| D. | CaCO3(s)+2HCl(aq)═CaCl2(aq)+CO2(g)+H2O(l) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | V=896 | B. | 滤液A中的阳离子为Fe2+、Fe3+、H+ | ||
| C. | 样品中CuO的质量为4.0g | D. | 样品中Fe元素的质量为2.24g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
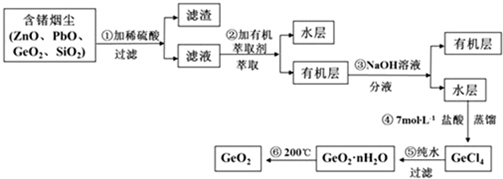
 (3)第④步加入盐酸作用中和NaOH,作反应物,抑制GeCl4水解(答两点即可).
(3)第④步加入盐酸作用中和NaOH,作反应物,抑制GeCl4水解(答两点即可).查看答案和解析>>
科目:高中化学 来源: 题型:实验题
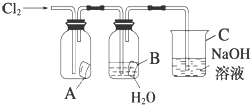 某同学按图进行实验,在A中放的是干燥的红色纸条,B中放的是湿润的红色纸条,C中盛放的是氢氧化钠溶液.请回答下列问题.
某同学按图进行实验,在A中放的是干燥的红色纸条,B中放的是湿润的红色纸条,C中盛放的是氢氧化钠溶液.请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都是共价化合物 | B. | 都是离子化合物 | C. | 互为同分异构体 | D. | 互为同系物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com