
【题目】下列属于酸性氧化物的是
A. CO2 B. CaO C. K2SO4 D. NaOH
科目:高中化学 来源: 题型:
【题目】利用盖斯定律解答下列各小题
(1)已知反应:H2(g)+ ![]() O2(g)═H2O(g)△H1N2(g)+2O2═2NO2(g)△H2
O2(g)═H2O(g)△H1N2(g)+2O2═2NO2(g)△H2![]() N2(g)+
N2(g)+ ![]() H2(g)═NH3(g)△H3
H2(g)═NH3(g)△H3
利用上述三个反应,计算4NH3(g)+7O2(g)═4NO2(g)+6H2O(g)的反应焓变为(用含△H1、△H2、△H3的式子表示).
(2)已知:CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.2kJmol﹣1CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=+247.4kJmol﹣1
则以甲烷为原料制取氢气是工业上常用的制氢方法.CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:

(1)写出该反应的化学方程式________________________________。
(2)计算反应开始到10s,用X表示的反应速率是______________。
(3)下列叙述中能说明上述反应达到平衡状态的是______________。
a.当X与Y的反应速率之比为1:1
b.混合气体中X的质量分数保持不变
c.X、Y、Z的浓度之比为1:1:2
(4)当反应达到平衡时,用Y表示的正反应速率v正(Y)与用Z表示的逆反应速率v逆(Z)的关系式是_________________。
(5)为使该反应的反应速率增大,可采取的措施是_______。
a.适当降低温度 b.扩大容器的体积 c.充入一定量Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的位置如表所示,其中X元素的原子内层电子数是最外层电子数的一半,则下列说法中正确的是()

A. 钠与W可能形成Na2W2化合物
B. 由Z与Y组成的物质在熔融时能导电
C. W得电子能力比Q强
D. X有多种同素异形体,而Y不存在同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质有关用途与性质的对应关系错误的是( )
物质 | 用途 | 性质 | |
A | 小苏打 | 用于焙制糕点 | 小苏打能与碱反应 |
B | 金属钠 | 用于冶炼钛、锆等金属 | 金属钠有强还原性 |
C | 二氧化硫 | 常用于漂白秸秆、织物 | SO2能跟其中的有色物质结合 |
D | 铁粉 | 用于食品中的脱氧剂 | Fe具有还原性 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计实验探究碳、硅元素的非金属性的相对强弱。根据要求完成下列各题:
(1)实验装置:

填写所示仪器名称:B__________
(2)实验步骤:
连接仪器、_____________、加药品后,打开 a、然后滴入浓硫酸,加热
(3)问题探究:(已知酸性强弱:亚硫酸>碳酸)
①铜与浓硫酸反应的化学方程式是________________________________;装置E中酸性KMnO4溶液的作用是_____________________________;
②能说明碳元素的非金属性比硅元素非金属性强的实验现象是__________________;试管F中发生反应的离子方程式为_____________________。
③依据试管 D 中的反应,能否证明S的非金属性强于C的非金属性___(填 “能”或“否”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,从海水中提取食盐和溴的过程如图1: 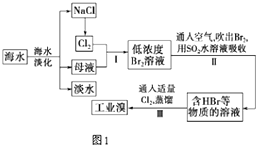
(1)请列举海水淡化的两种方法:、 .
(2)步骤I中己获得Br2 , 步骤II中又将Br2还原为Br﹣ . 其目的是 .
(3)步骤II用SO2水溶液吸收Br2 , 吸收率可达95%.有关反应的离子方程式为 .
(4)某化学研究性学习小组为了了解从工业溴中提纯溴的方法.查阅了有关资料知:Br2的沸点为59℃.微溶于水,有毒并有强腐蚀性.他们参观生产过程后.画了如图2装置简图: 
请你参与分析讨论:
①图中仪器B的名称是 .
②整套实验装皿中仪器连接均不能用橡胶塞和橡胶管.其原因是 .
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件? .
④C中液体颜色为 . 为除去该产物中仍残留的少量Cl2 , 可向其中加入NaBr,溶液,充分反应后.再进行的分离操作是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学常见反应的化学方程式是A+B→X+Y+H2O(未配平,反应条件略去),其中A、B的物质的量之比为了1:4.请回答:
(1)若Y是黄绿色气体,则Y的电子式是 , 该反应的离子方程式是 .
(2)若A为非金属单质,构成它的原子核外最外层电子数是次外层电子数的2倍,B的溶液为某浓酸,则反应中氧化剂与还原剂的物质的量之比是 .
(3)若A为金属单质,常温下A在B的浓溶液中“钝化”,且A可溶于X溶液中. ①A元素在周期表中的位置是(填所在周期和族);Y的化学式是 .
②含amol X的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量恰好相等,则被还原的X是
mol.
(4)若A、B、X、Y均为化合物.向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀;B的焰色为黄色.则A与B按物质的量之比1:4恰好反应后,溶液中离子浓度从大到小的顺序是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com