解:(1)根据稀释定律,稀释前后溶质硫酸的物质的量不变,设浓硫酸的体积为xmL,所以xmL×2.4mol/L=100mL×0.2mol/L,解得:x≈8.3,所以应量取的硫酸体积是8.3mL;
故答案为:8.3mL;
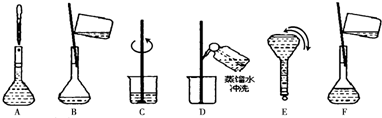
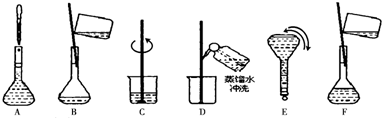
(2)配制步骤有量取、稀释、移液、洗涤、定容、摇匀等操作,用10mL量筒量取(用到胶头滴管)硫酸,在烧杯中稀释,并用玻璃棒搅拌,冷却后转移到100mL容量瓶中,并用玻璃棒引流,洗涤烧杯与玻璃棒2~3次,并移入容量瓶内,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,盖好瓶塞,反复颠倒摇匀,故操作顺序为CAFDBEG;
故答案为:胶头滴管,100mL容量瓶,CAFDBEG;
(3)白色沉淀是硫酸钡,硫酸钡的物质的量为
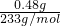
=
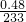
mol,所以n(H
2SO
4)=n(BaSO
4)=
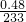
mol,故所配硫酸溶液的浓度为
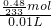
=0.21mol/L>0.2mol/L;
A.定容时俯视容量瓶,所配溶液体积偏小,配制人一样的浓度偏大,故A符合;
B.用量筒取2.4mol/LH
2SO
4溶液时俯视读数,量取硫酸溶液的体积偏小,所配溶液的浓度偏小,故B不符合;
C.配制需加水定容,使用容量瓶前未干燥,对所配溶液浓度无影响,故C不符合;
D.使用的烧杯和玻璃棒未洗涤彻底,移入容量瓶内溶质硫酸的物质的量偏小,所配溶液浓度偏小,故D不符合;
E.定容时将蒸馏水洒在容量瓶外面,可以继续加水,对所配溶液浓度无影响,故E不符合;
故答案为:大于,A.
分析:(1)根据稀释定律,稀释前后溶质硫酸的物质的量不变,据此计算需要硫酸的体积;
(2)根据配制溶液的实验操作过程进行步骤填空与实验步骤排序.
(3)白色沉淀是硫酸钡,根据n=

计算硫酸钡的物质的量,利用硫酸根守恒计算硫酸的物质的量,再根据c=

计算该硫酸溶液的浓度,据此判断;
分析操作对溶质的物质的量或对溶液的体积的影响,根据c=

分析对所配溶液浓度的影响.
点评:本题考查了一定物质的量浓度溶液的配制,难度不大,注意从c=

理解溶液配制与误差分析.

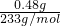 =
=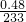 mol,所以n(H2SO4)=n(BaSO4)=
mol,所以n(H2SO4)=n(BaSO4)=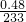 mol,故所配硫酸溶液的浓度为
mol,故所配硫酸溶液的浓度为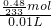 =0.21mol/L>0.2mol/L;
=0.21mol/L>0.2mol/L; 计算硫酸钡的物质的量,利用硫酸根守恒计算硫酸的物质的量,再根据c=
计算硫酸钡的物质的量,利用硫酸根守恒计算硫酸的物质的量,再根据c= 计算该硫酸溶液的浓度,据此判断;
计算该硫酸溶液的浓度,据此判断; 分析对所配溶液浓度的影响.
分析对所配溶液浓度的影响. 理解溶液配制与误差分析.
理解溶液配制与误差分析.