
Ⅰ.(8分)某同学为了探究氯化铵的性质,进行了如下实验,请你按要求回答下列问题。
(1)配制100mL1mol/L的NH4Cl溶液。该同学应用托盘天平称量NH4Cl固体的质量为 g。
有以下仪器:烧杯、胶头滴管、玻璃棒等玻璃仪器。
①还缺少的仪器有 ;
②使用容量瓶前必须进行的一步操作是 ;
(2)该同学又用下图所示的装置做了有关氨气的性质实验。
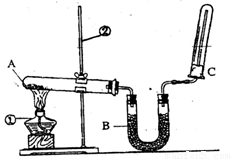
①写出实验室制氨气的化学方程式: ;
②写出B中盛放的是碱石灰其作用是 ;
③氨气极易溶于水,在氨水中滴加酚酞现象是 ;
④检验氨气的方法是 。
Ⅱ.(6分)在稀硝酸中放入足量的铜片:
(1)反应的化学方程式为 ;
(2)待反应停止后,再加入少量25%的稀硫酸,这时铜片上又有气泡产生,其原因是 。(用离子方程式表示)
(3)若将12.8g铜跟一定量的浓硝酸反应,铜消耗完时,共产生气体5.6L(标
准状况下)。则所消耗的硝酸的物质的量是 。
Ⅰ. (8分) (1)5.4g;①100mL容量瓶 ②检查是否漏水
(2)①⑴Ca(OH)2
+ NH4Cl 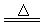 CaCl2 + 2NH3↑ + 2H2O
CaCl2 + 2NH3↑ + 2H2O
②吸收水蒸气 ③溶液由无色变为红色
④用湿润的红色石蕊试纸 或蘸有浓盐酸的玻璃棒(合理即可给分)
Ⅱ.(6分,每空2分)
(1)3Cu + 8HNO3(稀)= 3Cu(NO3)2 + 2NO↑ + 4H2O
(2)3Cu + 8H+ + 2NO3-= 3Cu2+ + 2NO↑ + 4H2O
(3)0.65mol
【解析】Ⅰ.(1)100mL1mol/L的NH4Cl溶液中溶质的物质的量是0.1L×1.0mol/L=0.1mol,质量是0.1mol×53.5g/mol=5.35g。因此如果用托盘天平称量,则质量是5.4g。
①根据所给仪器可知,还缺少100mL容量瓶。
②容量瓶在使用之前,必须检查是否漏水。
(2)①实验室制取氨气的方程式为Ca(OH)2 + NH4Cl  CaCl2
+ 2NH3↑ + 2H2O。
CaCl2
+ 2NH3↑ + 2H2O。
②氨气是碱性气体,所以干燥氨气需要用碱石灰。
③氨气溶于水,生成一水合氨,溶液显碱性,所以溶液由无色变为红色。
④利用氨气是碱性气体进行检验。所以检验氨气可以用湿润的红色石蕊试纸 或蘸有浓盐酸的玻璃棒。
Ⅱ.(1)硝酸具有强氧化性,能把铜氧化,反应式为3Cu + 8HNO3(稀)= 3Cu(NO3)2 + 2NO↑ + 4H2O。
(2)在反应中由硝酸铜生成。而在酸性溶液中,硝酸盐具有氧化性,可以继续氧化铜片,离子方程式为3Cu + 8H+ + 2NO3-= 3Cu2+ + 2NO↑ + 4H2O。
(3)5.6LNO在标准状况下的物质的量是0.25mol,则被还原的硝酸是0.25mol。铜是12.8g,物质的量是0.2mol,则生成硝酸铜也是0.2mol,所以没有被还原的硝酸是0.4mol。因此参加反应的硝酸是0.65mol。


 精英口算卡系列答案
精英口算卡系列答案科目:高中化学 来源: 题型:

| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ① |
| KSCN溶液 |
| 新制氯水 |
| 一段时间后 |
| 编号 | 猜想 |
| 假设1 | 新制的氯水具有漂白性,溶液被漂白 新制的氯水具有漂白性,溶液被漂白 |
| 假设2 | 溶液中的SCN-被过量的氯水氧化 |
| 假设3 | 溶液中的Fe3+被还原成Fe2+ 溶液中的Fe3+被还原成Fe2+ |
| 编号 | 实验操作 | 预期现象和结论 |
| ① | 取少量褪色后溶液,加入KSCN溶液 取少量褪色后溶液,加入KSCN溶液 |
如果溶液变红色,说明该同学的猜想是合理的;如果溶液不变红色,说明乙同学的猜想是不合理的 如果溶液变红色,说明该同学的猜想是合理的;如果溶液不变红色,说明乙同学的猜想是不合理的 |
| ② | 取少量褪色后溶液,加入FeCl3溶液 取少量褪色后溶液,加入FeCl3溶液 |
如果溶液仍不变红色,说明该同学的猜想是合理的;如果溶液变红色,说明该同学的猜想是不合理的 如果溶液仍不变红色,说明该同学的猜想是合理的;如果溶液变红色,说明该同学的猜想是不合理的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 猜想 |
| 甲 | 溶液中的+3价Fe又被还原为+2价Fe |
| 乙 | 溶液中的SCN-被过量的氯水氧化 |
| 丙 | 新制的氯水具有漂白性,将该溶液漂白 |
| 编号 | 实验操作 | 预期现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源:模拟题 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com