
| A. | $\frac{Vd}{MN+2240}$ | B. | $\frac{1000Vd}{MN-2240}$ | C. | $\frac{1000VdM}{MN+2240}$ | D. | $\frac{MN}{22.4(V+0.1)d}$ |
分析 根据n=$\frac{V}{Vm}$计算出该气体的物质的量,再根据n=nM计算出该气体的质量,从而得出该溶液的质量,然后根据V=$\frac{m}{ρ}$计算出所得溶液的体积,最后根据c=$\frac{n}{V}$计算出所得溶液的浓度.
解答 解:标准状况下VL该气体的物质的量为:n=$\frac{VL}{22.4L/mol}$=$\frac{V}{22.4}$mol,
溶液的质量为:0.1L水的质量约为100g,则所得溶液的质量为:100g+$\frac{MV}{22.4}$g,
所得溶液的体积:$\frac{100g+\frac{MV}{22.4}}{dg/L×1{0}^{3}}$L;
则此溶液的物质的量浓度(mol/L)为:$\frac{\frac{V}{22.4}}{\frac{100+\frac{MV}{22.4}}{d×1{0}^{3}}}$=$\frac{1000Vd}{MV+2240}$mol/L;
故选:C.
点评 本题考查学生利用物质的量浓度的定义式计算,明确溶液中的溶质的物质的量及溶液的体积即可计算,溶液的体积计算是解答本题的关键,并注意本题中应按照气体与水不反应来分析.


科目:高中化学 来源: 题型:选择题
| A. | v(B2)=0.9mol/(L•s) | B. | v(A2)=1.5mol/(L•s) | ||
| C. | v(C)=0.62mol/(L•s) | D. | v(B2)=90.0mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
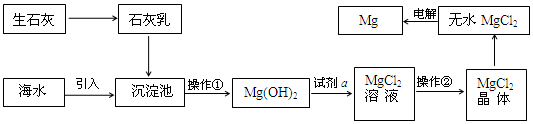
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 属于酯类的有4种 | |
| B. | 属于羧酸的有2种 | |
| C. | 存在有能使溴的四氯化碳溶液褪色的同分异构体 | |
| D. | 存在分子中含有五元环的酯类化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
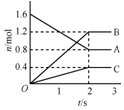 某温度下,在体积为5L的容器中,A、B、C三种物质物质的量随着时间变化的关系如图所示,则该反应的化学方程式为2A?3B+C,2s内用A的浓度变化的平均反应速率为0.08mol/(L•s).
某温度下,在体积为5L的容器中,A、B、C三种物质物质的量随着时间变化的关系如图所示,则该反应的化学方程式为2A?3B+C,2s内用A的浓度变化的平均反应速率为0.08mol/(L•s).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
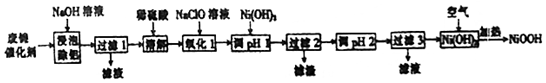
| 开始沉淀的pH | 完全沉淀的pH | |
| Ni2+ | 6.2 | 8.6 |
| Fe2+ | 7.6 | 9.1 |
| Fe3+ | 2.3 | 3.3 |
| Cr2+ | 4.5 | 5.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ•mol-1,则氢气的燃烧热为285.8 KJ/mol | |
| B. | 已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| C. | 已知含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l)△H=-57.4 kJ•mol-1 | |
| D. | 已知2C(s)+2O2(g)=2CO2(g)△H1;2C(s)+O2(g)═2CO(g)△H2,则△H1>△H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com