
分析 溶液无色,则一定不存在有色的Fe3+离子,与铝反应生成氢气,则溶液中存在大量氢离子或氢氧根离子,
(1)当生成Al3+时,说明溶液呈酸性,因在含HNO3的溶液中放入Al不生成H2,则一定不存在NO3-离子,与H+离子反应的离子不能大量共存;
(2)当生成AlO2-时,说明溶液呈碱性,溶液中存在大量的OH-离子,与OH-离子反应的离子不能大量共存,以此解答该题.
解答 解:无色透明溶液,说明原溶液中不存在Cu2+;铝既能与酸作用产生氢气,也能与碱作用产生氢气,
(1)当与酸作用时,溶液显酸性,则SO32-、HCO3-、OH-不存在,由于硝酸与金属反应一般没有氢气产生,因此也不存在NO3-,
根据溶液不显电性,一定存在阴离子,即溶液中肯定有SO42-,而Ag+、Ba2+可与SO42-生成沉淀,说明原溶液中也不存在Ag+、Ba2+,
即此时溶液中一定含H+、SO42-,可能存在Mg2+离子,
故答案为:H+、SO42-;Mg2+;
(2)当溶液显碱性时,Mg2+、Cu2+、H+、Ag+、HCO3-不能存在,根据溶液不显电性,一定存在阳离子,即阳离子只有Ba2+,
说明原溶液中的阴离子只能是OH-、NO3-,则原溶液中一定存在的离子为OH-、Ba2+,可能存在NO3-,
故答案为:OH-、Ba2+;NO3-.
点评 本题考查Al的化学性质及离子的共存问题,为高频考点,明确常见离子之间的反应是解答本题的关键,并注意利用溶液为电中性、离子的颜色等来分析解答,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,化合物 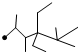 的名称是 2,3,5,5-四甲基-4,4-二乙基己烷 的名称是 2,3,5,5-四甲基-4,4-二乙基己烷 | |
| B. | 等物质的量的苯和苯甲酸完全燃烧消耗氧气的量不相等 | |
| C. | 苯与甲苯互为同系物,均能使KMnO4酸性溶液褪色 | |
| D. | 结构片段为 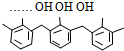 …的高聚物,其单体是甲醛和苯酚 …的高聚物,其单体是甲醛和苯酚 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
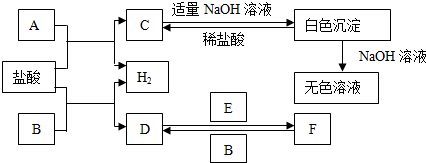
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
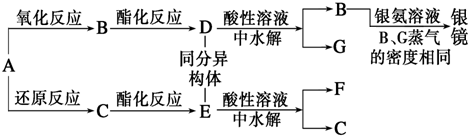
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
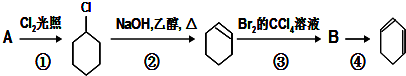
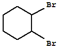 ;
; +Cl2 $\stackrel{光照}{→}$
+Cl2 $\stackrel{光照}{→}$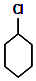 +HCl.
+HCl.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
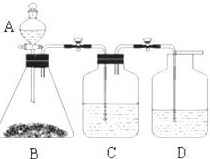 为了确定醋酸溶液、二氧化碳水溶液、苯酚溶液的酸性强弱,有人设计了如图所示的装置进行实验:
为了确定醋酸溶液、二氧化碳水溶液、苯酚溶液的酸性强弱,有人设计了如图所示的装置进行实验:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
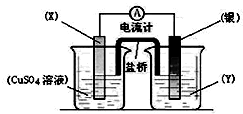 用如图装置实现原电池反应:Cu+2Ag+═Cu2++2Ag
用如图装置实现原电池反应:Cu+2Ag+═Cu2++2Ag查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com