据新闻报道有全国最“绿”省份之称的福建,近年来却频频受到酸雨的困扰.在饮用水源地水质状况方面,福建9个设区市的34个集中式生活饮用水源地水质达标率为73.3%,较上年同期有所下降.所以保护环境是我们刻不容缓的责任.
Ⅰ、烟气脱硫是控制二氧化硫污染的主要技术手段.
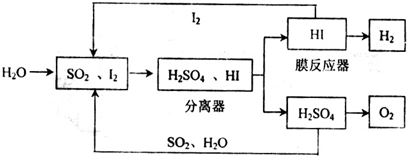
(1)利用海水脱硫是一种有效的方法,其工艺流程如图1所示:
某研究小组为探究提高含硫烟气中SO
2的吸收效率的措施,进行了天然海水(pH≈8)吸收含硫烟气的模拟实验,实验结果如图2所示.
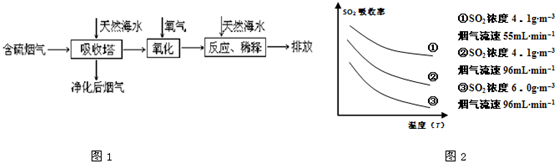
①根据图示实验结果,为了提高一定浓度含硫烟气中SO
2的吸收效率,下列措施正确的是
AB
AB
.(填字母序号)
A.降低通入含硫烟气的温度 B.减小通入含硫烟气的流速
C.减少天然海水的进入量 D.在天然海水中加入生石灰
②天然海水吸收了含硫烟气后会溶有H
2SO
3,使用空气中的氧气将其氧化,写出该反应的化学方程式:
2H2SO3+O2=2H2SO4
2H2SO3+O2=2H2SO4
.氧化后的“海水”需要用大量的天然海水与之混合后才能排放,该操作的主要目的是
中和、稀释经氧气氧化后海水中生成的酸(H+)
中和、稀释经氧气氧化后海水中生成的酸(H+)
.
(2)石灰石-石膏湿法烟气脱硫工艺技术的工作原理是烟气中的二氧化硫与浆液中的碳酸钙以及鼓入的空气反应生成石膏(CaSO
4?2H
2O).写出该反应的化学方程式:
2CaCO3+2SO2+O2+4H2O═2CaSO4?2H2O+2CO2
2CaCO3+2SO2+O2+4H2O═2CaSO4?2H2O+2CO2
.
Ⅱ.重金属离子对河流及海洋造成严重污染.某化工厂废水(pH≈2)中含有Ag
+、Pb
2+等重金属离子,其浓度各约为0.01mol?L
-1.排放前拟用沉淀法除去这两种离子,查找有关数据如下:
| 难溶电解质 |
AgI |
AgOH |
Ag2S |
PbI2 |
Pb(OH)2 |
PbS |
| Ksp |
8.3×10-17 |
5.6×10-8 |
6.3×10-50 |
7.1×10-9 |
1.2×10-15 |
3.4×10-28 |
(3)你认为往废水中投入
B
B
(填字母序号),沉淀效果最好.
A.NaOH B.Na
2S C.KI D.Ca(OH)
2(4)如果只用生石灰处理含有Pb
2+的废水,使溶液的pH=8.0,处理后的废水中,c(Pb
2+)=
1.2×10-3mol?L-1
1.2×10-3mol?L-1
.若环境要求污水综合排放标准为c(Pb
2+)低于1.0×l0
-8mol?L
-1,问处理后的废水是否符合排放标准?
否
否
(填“是”或“否”).