
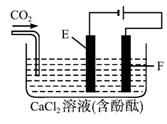
图1-2-24
(1)电解时F极发生_________反应,电极反应式为__________________;E极发生反应,电极反应式为___________________________;
(2)电解时电解池中产生的现象是__________________,电解后持续通入CO2产生的现象是____________________________________________________________________。
解析:由题目所给图示知,F作阳极发生氧化反应,由于还原性Cl->OH-,所以电极反应为2Cl--2e-====Cl2↑,E极作阴极发生还原反应,由于H+的氧化性大于Ca2+,所以电极反应为2 H++2e-====H2↑,随着电解的不断进行,E极的附近碱性不断增强,生成Ca(OH)2,溶液呈红色,通入CO2时,发生反应Ca2++2H-+CO2====CaCO3↓+H2O,溶液变浑浊。持续通入CO2时,又发生反应CaCO3+CO2+H2O====Ca2++![]() ,所以先产生的白色沉淀又会溶解。
,所以先产生的白色沉淀又会溶解。
答案: (1)氧化 2Cl--2e-====Cl2↑
还原 2H++2e-====H2↑
(2)E极附近溶液变红色 溶液变浑浊,先产生白色沉淀,后沉淀溶解


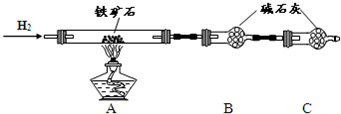
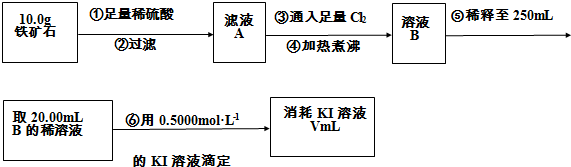
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 1.容器 | 2.甲 | 3.乙 | 4.丙 |
| 5.反应物投入量 | 6.1molCO、2molH2 | 7.l molCH3OH | 8.2molCO、4molH2 |
| 9.CH30H昀浓度(mol/L) | 10.cl | 11.c2 | 12.c3 |
| 13.反应的能量变化 | 14.放出Q1kJ | 15.吸收Q2kJ | 16.放出Q3kJ |
| 17.平衡常数 | 18.Kl | 19.K2 | 20.K3 |
| 21.反应物转化率 | 22.al | 23.a2 | 24.a3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
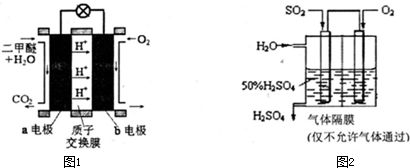
(分)膜技术原理在化工生产中有着广泛的应用。有人设想利用电化学原理制备少量硫酸和绿色硝化剂N2O5,装置图如下。
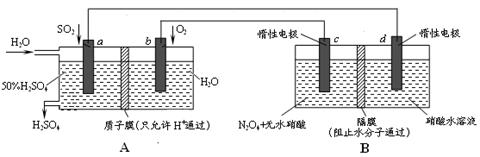
⑴A装置是________,B装置是_________(填“原电池”或“电解池”)。
⑵N2O5在电解池的______区生成,其电极反应式为_____________________________。
⑶通入O2一极的电极反应式为_______________________________。
⑷若通入SO2的速率为2.24 L·min-1(标准状况),为稳定持续生产,硫酸溶液的浓度应维持不变,则左侧水的流入速率应为_________mL·min-1。
查看答案和解析>>
科目:高中化学 来源:2013年广东省高考化学试卷(解析版) 题型:填空题
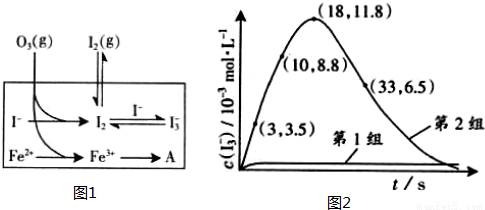
| 编号 | 反应物 | 反应前pH | 反应后pH |
| 第1组 | O3+I- | 5.2 | 11.0 |
| 第2组 | O3+I-+Fe2- | 5.2 | 4.1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com