
【题目】下列关于药物的说法正确的是( )
A.药物的服用剂量越大,治疗效果越明显
B.包装上印有“OTC“标志的药品属于处方药
C.氢氧化铝可作为抑酸剂,用于治疗胃酸过多
D.长期大量服用阿司匹林可预防某些疾病,没有副作用
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.95℃纯水的pH<7,说明加热可导致水呈酸性
B.向水中加入少量稀硫酸,c(H+)增大,KW不变
C.向水中加入氨水,水的电离平衡向正反应方向移动,c(OH﹣)增大
D.pH=3的醋酸溶液,稀释至10倍后pH=4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.化学反应的发生都需要在一定条件下
B.灼热的碳与二氧化碳的反应是放热反应
C.由C(石墨)+1.9kJ·mol-1→C(金刚石)可知,金刚石比石墨稳定
D.等量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列各组微粒或物质:
A. O2和O3 B.![]() 和
和![]() C.
C. 
D. 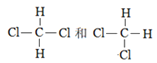 E.
E. 
(1)互为同位素的是________(填序号,下同);属于同系物的是__________;属于同一种物质的是______________;互为同分异构体的是_______________。
(2)E组中的两种物质的名称分别是________________、_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、D、E、F、G是原子序数依次增大的六种短周期元素。A和B能形成B2A和B2A2两种化合物,B、D、G的最高价氧化物对应水化物两两之间都能反应,D、F、G原子最外层电子数之和等于15。回答下列问题:
(1)E元素在元素周期表中的位置是___________;A离子的结构示意图为____________。
(2)D的单质与B的最高价氧化物对应水化物的溶液反应,其离子方程式为________。
(3)①B2A2中含有___________键和___________键。
②该物质与水反应的化学反应方程式为___________________。
(4)下列说法正确的是____________(填字母序号)。
①B、D、E原子半径依次减小
②六种元素的最高正化合价均等于其原子的最外层电子数
③D的最高价氧化物对应水化物可以溶于氨水
④元素气态氢化物的稳定性:F>A>G
(5)在E、F、G的最高价氧化物对应水化物中,酸性最强的为__________(填化学式),用原子结构解释原因:同周期元素电子层数相同,从左至右,__________,得电子能力逐渐增强,元素非金属性逐渐增强。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是一门实用性的学科,以下叙述正确的是( )
A. 静置后的淘米水能产生丁达尔现象,这种“淘米水”是胶体
B. “洁厕灵”有效成分为盐酸,与漂白粉混合使用效果更佳
C. 活泼金属的冶炼常用电解方法,如电解NaCl溶液就可制备Na
D. 铝热反应中可得到铁,工业上可以利用该反应来大量生产铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有着“植物大熊猫”和世界上最长寿树种美称、在地球上已有250万年历史的红豆杉,入选2010年世博会中国馆珍稀植物展出品种。其体内含量最多的化学元素和最基本的化学元素分别是( )
A. C和O B. C和H C. O和C D. H和O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】活性氧化锌(ZnO)粒径介于1-100 nm之间,是一种面向21世纪的新型高功能精细无机产品,表现出许多特殊的性质。某研究所以粗氧化锌(含少量CuO、FeO、MnO、Fe2O3等)为原料,采用湿化学法(NPP-法)制备纳米级活性氧化锌,生产工艺流程如图:

已知:
①pH=5.4时,KMnO4的还原产物为MnO2。
②以上实验条件下各种氢氧化物沉淀的pH情况如下表所示。
Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | Zn(OH)2 | Mn(OH)2 | |
开始沉淀的pH | 7.5 | 2.2 | 5.2 | 6.4 | 8.6 |
沉淀完全的pH | 9.0 | 3.2 | 6.7 | 8.0 | 10.1 |
根据以上信息,回答下列问题:
(1)工艺过程中各步骤均用到的分离方法是_______________________________。
(2)“废渣1”的主要成分是______________________________________________。
(3)“反应器2”中两个氧化还原反应的离子方程式为_______________________________________________________________
(4) “反应器3”中加入锌粉的作用是________________________________。
(5)“反应器4”得到的废液中,含有的主要离子除了Na+外,还有______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
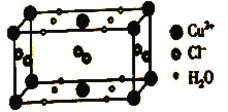
【题目】将过量的氨水加到硫酸铜溶液中,溶液最终变成深蓝色,继续加入乙醇,析出深蓝色的晶体[Cu(NH3)4]SO4·H2O。
(1)Cu2+基态核外电子排布式为________________________;[Cu(NH3)4]SO4·H2O中,不考虑空间构型,[Cu(NH3)4]2+的结构可用示意图表示为___________。
(2)乙醇分子中C原子轨道杂化类型为___________,H2O与H+以配位键形成H3O+,则H3O+的空间构型为__________(用文字描述)。
(3)N、O、S第一电离能由大到小的顺序为____________________。
(4)某含有结晶水的铜的氯化物的晶胞结构如图所示,该化合物的化学式是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com