
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 陈述Ⅲ |
| A | 加压有利于提高SO2的转化率 | 工业生产硫酸常在高温下进行 | Ⅰ对,Ⅱ对;有 |
| B | Cl2和SO2混合后可用来漂白纸浆 | Cl2和SO2都有较好的漂白作用 | Ⅰ对,Ⅱ错;无 |
| C | 工业生产硫酸用水吸收SO3 | SO3可与水反应 | Ⅰ对,Ⅱ对;有 |
| D | 石墨常用作电解池的电极 | 石墨的化学性质稳定且导电性好 | Ⅰ对,Ⅱ对;有 |
| A、A | B、B | C、C | D、D |


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
| A、向碳酸氢铵溶液中加入过量的NaOH固体 NH4++OH-=NH3↑+H2O |
| B、澄清的石灰水与稀盐酸反应 Ca(OH)2+2H+=Ca2++2H2O |
| C、铜片插入硝酸银溶液中 Cu+Ag+=Cu2++Ag |
| D、碳酸钙溶于稀盐酸中 CaCO3+2H+=Ca2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在AgBr饱和溶液中加入AgNO3溶液,达到平衡时,溶液中Br-浓度降低 |
| B、常温下,pH=4的溶液一定是酸溶液 |
| C、FeCl3溶液和Fe2(SO4)3溶液加热蒸干、灼烧都得到Fe2O3 |
| D、在滴有酚酞的Na2CO3溶液中加入BaCl2溶液,溶液褪色,说明BaCl2溶液有酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
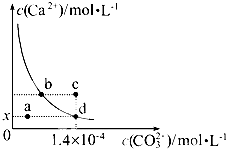 室温时,CaCO3在水中的溶解平衡曲线如图所示,已知:25℃其溶度积为2.8×10-9,下列说法不正确的是( )
室温时,CaCO3在水中的溶解平衡曲线如图所示,已知:25℃其溶度积为2.8×10-9,下列说法不正确的是( )| A、加入蒸馏水可使溶液由d点变到a点 |
| B、c点时有碳酸钙沉淀生成 |
| C、x数值为2×10-5 |
| D、b点与d点对应的溶度积相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④ | B、③②①④ |
| C、④③①② | D、③②④① |
查看答案和解析>>
科目:高中化学 来源: 题型:
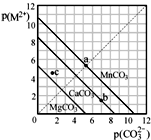 一定温度下,三种碳酸盐MCO3(M2+:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示.已知 p(M2+)=-lgc(M2+),p(CO32-)=-lgc(CO32-).下列说法正确的是( )
一定温度下,三种碳酸盐MCO3(M2+:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示.已知 p(M2+)=-lgc(M2+),p(CO32-)=-lgc(CO32-).下列说法正确的是( )| A、MgCO3、CaCO3、MnCO3的Ksp依次增大 |
| B、c点若表示MgCO3则为不饱和溶液,若表示CaCO3则有沉淀析出 |
| C、b点可表示CaCO3的饱和溶液,且Ca2+浓度与CO32-浓度相等 |
| D、在100mL MgCO3、CaCO3、MnCO3饱和的混和溶液中加入足量浓K2CO3溶液,产生沉淀MnCO3质量最多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
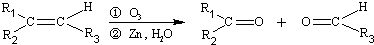 (R1、R2、R3代表烃基)
(R1、R2、R3代表烃基)
 :
:
 属芳香醚,其同系物的通式为:
属芳香醚,其同系物的通式为:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com