
【题目】下表是室温下,几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb):
酸或碱 | 电离常数(Ka或Kb) |
CH3COOH | Ka=1.75×10-5 |
柠檬酸(H3C6H5O7) | Ka1=7.4×10-4 Ka2=1.73×10-5 Ka3=4.0×10-7 |
NH3·H2O | Kb=1.75×10-5 |
请回答下列问题:
(1)用蒸馏水稀释0.1 mol/L的醋酸溶液,下列选项中一定变小的是__________(填字母)。
A.![]()
B.c(H+)
C.c(OH-)·c(H+)
D.![]()
E.![]()
(2)浓度为0.10 mol/L柠檬酸氢二钠(Na2HC6H5O7)溶液显_____(填“酸”“碱”或“中”)性,通过计算说明其原因____
【答案】B 酸性 因为Ka3=4.0×10-7,Kh2=![]() =
=![]() <Ka3,所以显酸性
<Ka3,所以显酸性
【解析】
(1)醋酸是弱电解质,越稀越电离。
(2)弱酸的酸式盐显酸性或者碱性,是通过比较电离和水解的相对强弱。
(1)A.用蒸馏水稀释0.1 mol/L的醋酸溶液,![]() 可变形为
可变形为![]() ,稀释过程中,温度不变,醋酸根离子浓度减小,Ka不变, 故选项A数据增大,不符合题意;
,稀释过程中,温度不变,醋酸根离子浓度减小,Ka不变, 故选项A数据增大,不符合题意;
B.用蒸馏水稀释0.1 mol/L的醋酸溶液,酸性变小,即c(H+)变小,B符合题意;
C.c(OH-)·c(H+)即为Kw,温度不变,Kw不变,故C项不符合题意;
D.![]() 即为Ka,温度不变,Ka不变,故D项不符合题意;
即为Ka,温度不变,Ka不变,故D项不符合题意;
E.用蒸馏水稀释0.1 mol/L的醋酸溶液, c(H+)变小,由于Kw不变,c(OH-)变大,则![]() 变大,故E项不符合题意;
变大,故E项不符合题意;
综合以上,本题选B。
(3).浓度为0.10 mol/L柠檬酸氢二钠(Na2HC6H5O7)中,弱酸根的电离常数Ka3=4.0×10-7,而水解常数Kh2=![]() =
=![]() <Ka3, 电离程度大于水解程度,所以溶液显酸性。
<Ka3, 电离程度大于水解程度,所以溶液显酸性。


科目:高中化学 来源: 题型:
【题目】一定量的某磁黄铁矿(主要成分FexS,S为-2价)与100mL盐酸恰好完全反应(矿石中其他成分不与盐酸反应),生成3.2g硫单质、0.4molFeCl2和一定量H2S气体,且溶液中无Fe3+。则下列说法正确的是( )
A.该盐酸的物质的量浓度为4.0mol·L-1
B.该磁黄铁矿FexS中,Fe2+与Fe3+的物质的量之比为2:1
C.生成的H2S气体在标准状况下的体积为8.96L
D.该磁黄铁矿中FexS的x=0.85
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上从海水中提取镁的流程如图所示,据此回答下列问题:
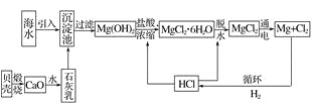
(1)在沉淀池中加入石灰乳的作用是__。
(2)生产过程中,过滤得到的Mg(OH)2沉淀中混有少量Ca(OH)2,实验室中除去Mg(OH)2沉淀中混有的少量Ca(OH)2的方法:先将沉淀加入到盛有__溶液的烧杯中,充分搅拌后经___(填操作方法,下同)、__、__,即可得到纯净的Mg(OH)2。
(3)下列关于题述流程中海水提镁的说法不正确的是__(填字母)。
A.此法的优点之一是原料来源丰富
B.副产品可用于氯碱工业
C.电解时会产生氯气
D.该流程中涉及的化学反应有分解反应、化合反应和置换反应
(4)电解无水氯化镁(熔融态)所得的镁蒸气在特定环境中冷却后可得到固体金属镁,则下列物质可用作镁蒸气的冷却剂的是___(填序号)。
A.H2 B.N2 C.空气 D.O2 E.水蒸气
(5)在SO2中点燃的镁条像在CO2中那样继续燃烧,但反应较镁和CO2反应更为剧烈,反应结束后,在盛有SO2的广口瓶中可能存在的物质是___(写化学式),反应的化学方程式为__、__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从物质A(某正盐)的水溶液出发有下面所示的一系列变化:
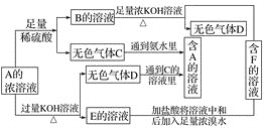
(1)写出A~F物质的化学式:
A__________;B__________;C__________;D__________;E.__________;F__________。
(2)写出E→F的化学方程式______________________________。
(3)鉴别物质F中阴离子的方法是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高血脂是一种常见的心血管疾病,治疗高血脂的新药I的合成路线如下(A~I)均为有机物):

已知:a. 
b.  RCHO
RCHO
回答下列问题:
(1)反应①的化学方程式为_______;F的官能团名称为______。
(2)反应②的类型是_______。D→E所需试剂、条件分别是_______、______。
(3)G的结构简式为____________。
(4)芳香族化合物W的化学式为C8H8O2, 且满足下列条件的W的结构共有_______种(不考虑立体异构)。
i.遇FeCl3溶液显紫色; ii.能发生银镜反应。
其中核磁共振氢谱显示有5种不司化学环境的氢,峰面积比为2:2:2:1:1的是____________(写出结构简式)。
(5)设计以甲苯和乙醛为原料制备 的合成路线。无机试剂任选,合成路线的表示方式为:
的合成路线。无机试剂任选,合成路线的表示方式为:![]() _____________.
_____________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下用NaOH溶液滴定H2C2O4溶液的过程中,溶液中-lg![]() 和-lg c(HC2O4-)或-lg
和-lg c(HC2O4-)或-lg![]() 和-lg c(C2O42-)的关系如图所示。下列说法正确的是( )
和-lg c(C2O42-)的关系如图所示。下列说法正确的是( )
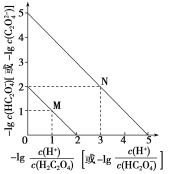
A.Ka1(H2C2O4)数量级为10-1
B.曲线N表示-lg![]() 和-lg c(HC2O4-)的关系
和-lg c(HC2O4-)的关系
C.向NaHC2O4溶液中加NaOH至c(HC2O4-)和c(C2O4-)相等,此时溶液pH约为5
D.在NaHC2O4溶液中c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】曲美替尼是一种抑制黑色素瘤的新型抗癌药物,下面是合成曲美替尼中间体G的反应路线:
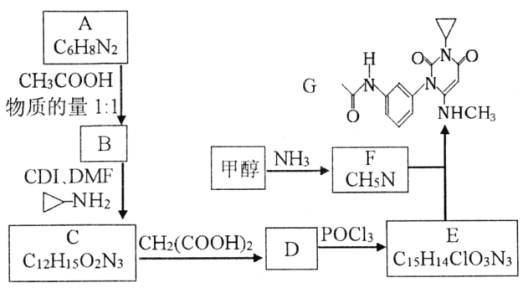
已知:①D分子中有2个6元环;
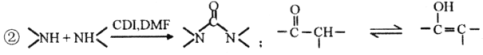
请回答:
(1)化合物A的结构简式___________。A生成B的反应类型___________。
(2)下列说法不正确的是___________。
A.B既能表现碱性又能表现酸性
B.1moC在碱溶液中完全水解最多可以消耗4 molOH-
C.D与POCl3的反应还会生成E的一种同分异构体
D.G的分子式为C16H18O3N4
(3)写出C→D的化学方程式____________________________________________。
(4)X是比A多2个碳原子的A的同系物,写出符合下列条件的X可能的结构简式:_______________________________________________________。
①1H-NMR谱显示分子中有3种氢原子,②IR谱显示分子中有苯环与-NH2相连结构
(5)流程中使用的DMF即N,N-二甲基甲酰胺结构简式为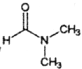 ,是常用的有机溶剂。设计以甲醇和氨为主要原料制取DMF的合成路线(用流程图表示,其他无机试剂任选)。_____________
,是常用的有机溶剂。设计以甲醇和氨为主要原料制取DMF的合成路线(用流程图表示,其他无机试剂任选)。_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用活性炭还原处理氮氧化物,有关反应为C(s)+2NO(g) ![]() N2(g)+CO2(g)。
N2(g)+CO2(g)。
(1)写出上述反应的平衡常数表达式_______________。
(2)在2L恒容密闭器中加入足量C与NO发生反应,所得数据如表,回答下列问题。
实验编号 | 温度/℃ | 起始时NO的物质的量/mol | 平衡时N2的物质的量/mol |
1 | 700 | 0.40 | 0.09 |
2 | 800 | 0.24 | 0.08 |
①结合表中数据,判断该反应的△H____0(填“>”或“<”),理由是_________。
②判断该反应达到平衡的依据是_______。
A.容器内气体密度恒定 B.容器内各气体浓度恒定
C.容器内压强恒定 D.2v正(NO)= v逆(N2)
(3)700℃时,若向2L体积恒定的密闭容器中充入一定量N2和CO2发生反应:N2(g)+CO2(g)![]() C(s)+2NO(g) ;其中N2、NO物质的量随时间变化的曲线如下图所示。请回答下列问题。
C(s)+2NO(g) ;其中N2、NO物质的量随时间变化的曲线如下图所示。请回答下列问题。
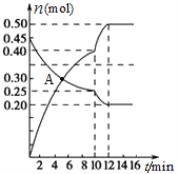
①0~10 min内的CO2平均反应速率v=____________。
②图中A点v(正)___v(逆)(填“>”、“<”或“=”)。
③第10 min时,外界改变的条件可能是_____________。
A.加催化剂 B.增大C的物质的量
C.减小CO2的物质的量 D.升温 E.降温
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】滴定法是解决化学分析问题的常用方法。滴定的方法有酸碱中和滴定、氧化还原滴定、沉淀滴定、络合滴定等。
I.如图为某浓度的NaOH溶液滴定10.00mL一定浓度的盐酸的示意图。根据图像

(1)HCl溶液的浓度是__________;NaOH溶液的浓度是_______;
(2)x=________。
(3)若向20mL稀氨水中逐滴加入等浓度的盐酸,则下列变化趋势正确的是________(填字母)。


ΙΙ.氧化还原滴定实验与中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。
(4)人体血液里Ca2+的浓度一般采用mg/cm3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度,抽取血样20.00mL,经过上述处理后得到草酸,再用0.020mol/L KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00mL KMnO4溶液。
滴定的实验数据如下所示:
实验编号 | 待测血液的体积/mL | 滴入KMnO4溶液的体积/mL |
1 | 20.00 | 11.95 |
2 | 20.00 | 13.00 |
3 | 20.00 | 12.05 |
①滴定时,盛放高锰酸钾溶液的仪器名称为_________确定反应达到终点的现象_____________。
②草酸跟酸性KMnO4溶液反应的离子方程式为:2MnO42-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O,根据所给数据计算血液样品中Ca2+离子的浓度为__________mg/cm3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com