
| A. | 向硫酸钡沉淀中加入浓碳酸钠溶液充分搅拌后,取沉淀(洗净)放入盐酸中有气泡产生,说明Ksp(BaCO3)<Ksp(BaSO4) | |
| B. | 向淀粉溶液中加入稀硫酸并加热片刻,然后再加入适量银氨溶液进行水浴加热,没有银镜生成,说明淀粉没有水解 | |
| C. | 将二氧化硫气体通入到高锰酸钾酸性溶液中,溶液紫红色褪去,说明二氧化硫有漂白性 | |
| D. | 向碳酸钠溶液中滴加几滴酚酞试液,然后再加入氯化钡溶液,溶液红色褪去,说明碳酸钠溶液中存在水解平衡 |
分析 A.Ksp(BaCO3)>Ksp(BaSO4);
B.银镜反应应在碱性条件下进行;
C.二氧化硫与高锰酸钾发生氧化还原反应,高锰酸钾被还原而褪色;
D.Na2CO3溶液存在水解平衡,加氯化钡与碳酸根离子反应,水解平衡逆向移动.
解答 解:A.常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,部分BaSO4因饱和Na2CO3溶液中高浓度CO32-转化为BaCO3,因此向洗净的沉淀中加稀盐酸,有气泡产生,但是Ksp(BaCO3)>Ksp(BaSO4),故A错误;
B.淀粉在酸性条件下水解,而银镜反应应在碱性条件下进行,应先调节溶液呈碱性,故B错误;
C.将二氧化硫气体通入到酸性高锰酸钾溶液中,溶液褪色,体现了二氧化硫的还原性,故C错误;
D.Na2CO3溶液存在水解平衡,加氯化钡与碳酸根离子反应,水解平衡逆向移动,则红色逐渐褪去,故D正确.
故选D.
点评 本题考查化学实验方案的评价,涉及难溶电解质的溶解平衡、物质的检验、还原性以及盐类的水解等知识,侧重于学生的分析能力、实验能力和评价能力的考查,为高考常见题型和高频考点,注意把握实验的严密性和合理性,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 16 g O2中含有的氧分子数为NA | |
| B. | 1 mol Mg变为Mg2+时失去的电子数目为2NA | |
| C. | 常温常压下,11.2 L H2中含有的氢分子数为0.5NA | |
| D. | 1 mol•L-1 CaCl2溶液中含有的氯离子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
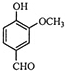
| A. | A的分子式是C8H10O3 | B. | A分子中含有酯基 | ||
| C. | A只能发生取代反应 | D. | A能与Na反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制5% NaCl溶液时,将已准确称量的NaCl放入烧杯中并加适量的水搅拌溶解 | |
| B. | 配制1mol•L-1 Na0H溶液时,将溶解后的NaOH溶液立即注入容量瓶 | |
| C. | 配制0.1mol•L-1的H2SO4溶液时,将量取的浓H2SO4放入容量瓶中加水稀释 | |
| D. | 配制1mol•L-1 Na2CO3溶液500mL,将Na2CO3放在托盘天平右盘称量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 步 骤 | 现 象 |
| Ⅰ.将NaCl溶液与AgNO3溶液混合 | 产生白色沉淀 |
| Ⅱ.向所得固液混合物中加Na2S溶液 | 沉淀变为黑色 |
| Ⅲ.将Ⅱ中经过滤洗得到的黑色沉淀分成两份,在一份沉淀中加蒸馏水,另一份沉淀中加入NaCl溶液,同时浸泡较长时间. | 加蒸馏水的沉淀仍为黑色,加入NaCl溶液的沉淀变为乳白色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
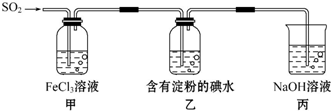
| A. | 为了验证Fe3+被SO2还原得到Fe2+,可向甲中加入KMnO4溶液,看紫红色是否褪去 | |
| B. | 甲中加入用稀盐酸酸化的BaCl2溶液,产生白色沉淀说明SO2可以被Fe3+氧化 | |
| C. | 能表明I-的还原性弱于SO2的现象是乙中蓝色溶液褪色 | |
| D. | 装置丙的作用是吸收SO2尾气,防止污染空气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NaCl、HCl、NaAlO2、NaHCO3 | B. | NaSO4、KNO3、(NH4)2SO4、MgCl2 | ||
| C. | FeCl3、NaOH、AlCl3、HNO3 | D. | AgNO3、NaCl、NaSO4、NaI |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 甲装置:可用来证明硫的非金属性比硅强 | |
| B. | 乙装置:用盐酸标准液测氢氧化钠溶液浓度 | |
| C. | 丙装置:配制一定物质的量浓度的氢氧化钠溶液 | |
| D. | 丁装置:可在瓶中先装满水,气体由②口入,收集NO气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com