
| 序号 | c(ClNO)/mol•L-1 | v/mol•L-1•s-1 |
| ① | 0.30 | 3.6×10-8 |
| ② | 0.60 | 1.44×10-7 |
| ③ | 0.90 | 3.24×10-7 |
分析 (1)将方程式2②-①得方程式③,方程式扩大2倍,化学平衡常数为原来的平方,两个方程式相减,则化学平衡常数相除;
(2)将$\frac{②}{①}$得n,将n代入①中得k;
(3)①可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量、物质的量浓度、百分含量以及由此引起的一系列物理量不变;
②v(ClNO)=$\frac{1mol/L}{10min}$=0.1mol/(L.min),同一时间段内各物质的反应速率之比等于其计量数之比,据此计算v(Cl2);
③开始c(NO)=$\frac{4mol}{2L}$=2mol/L、c(Cl2)=$\frac{2mol}{2L}$=1mol/L,
该反应中2NO(g)+Cl2(g)?2ClNO(g)
开始(mol/L)2 1 0
反应(mol/L)1 0.5 1
平衡(mol/L)1 0.5 1
化学平衡常数K=$\frac{{c}^{2}(ClNO)}{{c}^{2}(NO).c(C{l}_{2})}$;
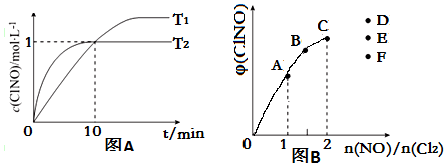
(4)NO的物质的量越大其转化率越小;当反应物的物质的量之比等于其计量数之比时生成物的含量最大,当n(NO)/n(Cl2)=2.8时产物的含量减小.
解答 解:(1)将方程式2②-①得方程式③,则K3=$\frac{{{K}_{2}}^{2}}{{K}_{1}}$,
故答案为:$\frac{{{K}_{2}}^{2}}{{K}_{1}}$;
(2)$\frac{1.44×1{0}^{-7}}{3.6×1{0}^{-8}}$=$\frac{k(0.60)^{n}}{k(0.30)^{n}}$,n=2,将n代入①中得k=$\frac{3.6×1{0}^{-8}}{(0.30)^{2}}$mol-1•L•s-1=4.0×10-7 mol-1•L•s-1,
故答案为:2;4.0×10-7 mol-1•L•s-1;
(3)①a.恒容条件下,容器体积始终保持不变,不能据此判断平衡状态,故错误;
b.反应前后气体的物质的量减小,压强越小,当容器压强保持不变时,正逆反应速率相等,反应达到平衡状态,故正确;
c.化学平衡常数只与温度有关,温度不变化学平衡常数不变,不能据此判断平衡状态,故错误;
d.只有氯气有色,当气体颜色保持不变,正逆反应速率相等,反应达到平衡状态,故正确;
e.v(ClNO)=v(NO)时,反应方向未知,无法确定是否达到平衡状态,故错误;
f.NO与 ClNO的物质的量比值保持不变时,正逆反应速率相等,反应达到平衡状态,故正确;
故选bdf;
②v(ClNO)=$\frac{1mol/L}{10min}$=0.1mol/(L.min),同一时间段内各物质的反应速率之比等于其计量数之比,据此得v(Cl2)=$\frac{1}{2}$v(ClNO)=$\frac{1}{2}$×0.1mol/(L.min)=0.05mol/(L.min),
故答案为:0.05 mol•L-1•min-1;
③开始c(NO)=$\frac{4mol}{2L}$=2mol/L、c(Cl2)=$\frac{2mol}{2L}$=1mol/L,
该反应中2NO(g)+Cl2(g)?2ClNO(g)
开始(mol/L)2 1 0
反应(mol/L)1 0.5 1
平衡(mol/L)1 0.5 1
化学平衡常数K=$\frac{{c}^{2}(ClNO)}{{c}^{2}(NO).c(C{l}_{2})}$=$\frac{{1}^{2}}{{1}^{2}×0.5}$L/mol=2L/mol,
故答案为:2L/mol;
(4)NO的物质的量越大其转化率越小,所以NO转化率最小的是C点;当反应物的物质的量之比等于其计量数之比时生成物的含量最大,当n(NO)/n(Cl2)=2.8时产物的含量减小,所以应该是F点,
故答案为:C;F.
点评 本题考查化学平衡计算、外界条件对化学平衡影响因素、化学平衡状态判断等知识点,侧重考查学生分析判断及计算能力,利用三段式法进行有关计算,注意(4)中当n(NO)/n(Cl2)=2时反应物的转化率相等且产物的含量最大,题目难度中等.


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 点燃氢气等易燃性气体前,必须检验气体的纯度 | |
| B. | 用嘴吹灭酒精灯火焰 | |
| C. | 加热试管里的液体时,试管口对着他人 | |
| D. | 把水注入浓硫酸中进行稀释 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
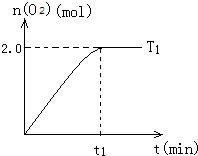 一定温度下,在2L密闭容器中加入纳米级Cu2O并通入10.0mol水蒸气,发生反应:2H2O(g)?2H2(g)+O2(g)△H=+484kJ/mol,T1温度下不同时段产生O2的量,见表:
一定温度下,在2L密闭容器中加入纳米级Cu2O并通入10.0mol水蒸气,发生反应:2H2O(g)?2H2(g)+O2(g)△H=+484kJ/mol,T1温度下不同时段产生O2的量,见表:| 时间/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 1.0 | 1.6 | 2.0 | 2.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
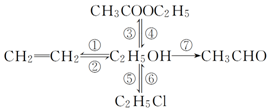 写出下列各物质相互转化的化学方程式,并说明各步的反应类型.
写出下列各物质相互转化的化学方程式,并说明各步的反应类型.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 操作步骤 | 现象 | 结论 |
| 取少量氯化铵产品于试管底部,加热 | 如果试管底部没有固体剩余 | 表明氯化铵产品纯净 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
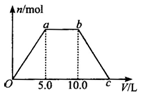 向Ba(OH)2和NaOH的混合稀溶液中通入足量的CO2气体,生成沉淀的物质的量(n)和通入CO2气体体积(V)的关系如图所示,试回答:
向Ba(OH)2和NaOH的混合稀溶液中通入足量的CO2气体,生成沉淀的物质的量(n)和通入CO2气体体积(V)的关系如图所示,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
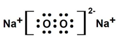
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com