
| A、加入的酸过量 |
| B、生成的盐不水解 |
| C、酸和碱等物质的量混合 |
| D、反应后溶液中c(A-)=c(M+) |


科目:高中化学 来源: 题型:
| A、纸上层析法通常以滤纸作为惰性支持物.滤纸纤维上的羟基具有亲水性,它所吸附的水作固定相 |
| B、重结晶时,溶质的溶解度越大、溶液冷却速度越慢,得到的晶体颗粒越大 |
| C、往海带灰的浸泡液中加入过量的氯水,以保证I-完全氧化为I2 |
| D、将3~4个火柴头浸于水中,片刻后取少量溶液于试管中,加AgNO3溶液、稀硝酸和NaNO2溶液,若出现白色沉淀,说明含有氯元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 阅读下列实验内容,根据题目要求回答问题.
阅读下列实验内容,根据题目要求回答问题.查看答案和解析>>
科目:高中化学 来源: 题型:


 也能发生类似V→Ⅵ的反应,请写出所生成醇的结构简式
也能发生类似V→Ⅵ的反应,请写出所生成醇的结构简式查看答案和解析>>
科目:高中化学 来源: 题型:
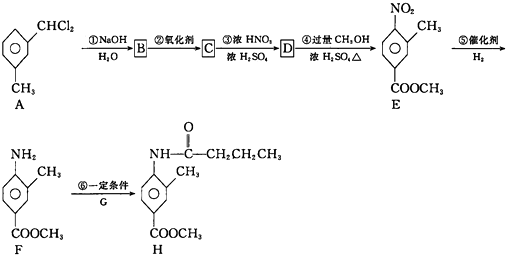
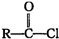
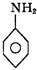 +
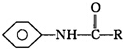
+
| 一定条件 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用丁达尔现象区分淀粉溶胶和豆浆 |
| B、钠和水反应实验时,余下的金属钠放回原瓶 |
| C、浓硫酸与浓硝酸混合时,将浓硝酸加入浓硫酸中 |
| D、蒸发结晶时,把液体蒸干再停止加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
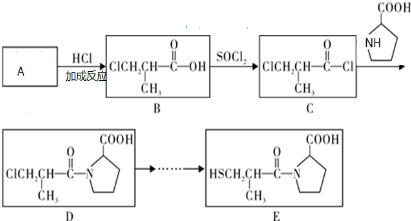
| NaOH |
| △ |
| H+ |
| 一定条件 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com