
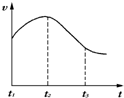
 某研究学习小组为探究锌与盐酸反应,取同质量、同体积的锌片,同浓度盐酸做了下列平行实验:
某研究学习小组为探究锌与盐酸反应,取同质量、同体积的锌片,同浓度盐酸做了下列平行实验:分析 (A)纯锌与稀盐酸反应,放出热量,速率加快,后期c(H+)起主导作用,随着反应进行c(H+)降低,反应速率减慢;
(B)锌片与FeCl3反应,导致与盐酸反应的锌的质量减少;
(C)不纯的锌片以及含有铜的锌可形成原电池反应,加快反应速率;
(D)还可增大固体表面积、加热、增大浓度等,以加快反应速率.
解答 解:(A)开始温度起主要作用,纯锌与稀盐酸反应,放出热量,温度升高,t1~t2速率加快;后期c(H+)起主导作用,随着反应进行c(H+)降低,t2~t3反应速率减慢;
故答案为:因为反应放热,溶液温度升高,反应速率加快;因为随反应进行,盐酸的浓度减小较大,反应速度减慢;
(B)锌片与FeCl3反应,导致与盐酸反应的锌的质量减少,生成氢气量减少,反应的离子方程式为Zn+2Fe3+=2Fe2++Zn2+,
故答案为:Zn+2Fe3+=2Fe2++Zn2+;
(C)不纯的锌片以及含有铜的锌可形成原电池反应,加快反应速率,故答案为:均为原电池的存在;
(D)还可增大固体表面积、加热、增大浓度等,以加快反应速率,故答案为:将锌片改为锌粉,加热,增大盐酸的浓度.
点评 本题考查学生对知识的迁移运用,涉及外界条件对反应速率的影响、原电池原理,为高频考点,侧重于学生的分析能力的考查,注意把握影响化学反应速率的因素,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Na+、HCO3-、K+、OH- | B. | Fe2+、H+、SO42-、NO3- | ||
| C. | Fe3+、SCN-、NH4+、Cl- | D. | AlO2-、OH-、Na+、NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3 NaHCO3 NaCl NH4Cl | |
| B. | Na2CO3 NaHCO3 NH4Cl NaCl | |
| C. | (NH4)2SO4 NH4Cl NaNO3 Na2S | |
| D. | NH4Cl (NH4)2SO4 Na2S NaNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
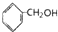
| A. | ①③ | B. | ①④⑤ | C. | ②④ | D. | ①②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2与Cl2混合后点燃与 H2 在Cl2中安静燃烧的反应速率是一样大的 | |
| B. | 反应物所具有的总能量高于产物所具有的总能量 | |
| C. | 断开1mol H-H键和1mol Cl-Cl键所吸收的总能量小于形成1mol H-Cl键所放出的能量 | |
| D. | 该反应中,化学能只转变为热能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨气可用排水法收集 | |
| B. | 氯化铵固体加热容易分解 | |
| C. | 氨气和酸相遇都能产生白烟 | |
| D. | 实验室用氢氧化钠溶液和氯化铵溶液加热制NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下硅性质活泼,可以与氯气、强酸、强碱溶液等起反应 | |
| B. | Na2O、Na2O2组成元素相同,与CO2反应产物也相同 | |
| C. | CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 | |
| D. | 新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.4 mol•(L•s)-1 | B. | 0.3 mol•(L•s)-1 | C. | 0.2 mol•(L•s)-1 | D. | 0.1 mol•(L•s)-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体比溶液更稳定 | |
| B. | 从外观一定能区别溶液和胶体 | |
| C. | 用渗析的方法净化胶体时,使用的半透膜只能让离子、小分子通过 | |
| D. | 淀粉溶液不是胶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com