
| A. | m=2 | |
| B. | X 与 Y 的平衡转化率之比为 1:2 | |
| C. | 两次平衡的平衡常数相同 | |
| D. | 第二次平衡时,Z 的浓度为 0.2 mol•L-1 |
分析 A.向平衡体系中再加入1molZ,重新建立平衡时X、Y、Z的体积分数不变,说明压强不影响该平衡,则反应前后总计量数相等,则1+m=3,m=2;
B.X、Y的初始浓度之比为1:2,计量数之比为1:2,则二者的转化率相等;
C.K只与温度有关;
D.根据重新达到平衡时Z的体积分数不变及反应过程中总物质的量不变计算出Z的物质的量,再根据c=$\frac{n}{V}$计算出Z的浓度,以此来解答.
解答 解:A.向平衡体系中再加入1molZ,重新建立平衡时X、Y、Z的体积分数不变,说明压强不影响该平衡,则反应前后总计量数相等,则1+m=3,m=2,故A正确;
B.向2L的密闭容器中加入1molX和2molY,由于m=2,则反应过程中消耗X、Y的物质的量之比为1:2,所以X、Y的转化率一定相等,故B错误;
C.K只与温度有关,温度不变,则两次平衡的平衡常数相同,故C正确;
D.再加入1molZ后总物质的量为4mol,重新达到平衡时Z的体积分数仍然为10%,则重新建立平衡时Z的浓度为$\frac{4mol×10%}{2}$=0.2mol/L,故D正确;
故选B.
点评 本题考查化学平衡的计算,为高频考点,把握压强对平衡移动的影响判断m及等效平衡为解答的关键,侧重分析与应用能力的考查,注意利用体积分数不变判断化学计量数关系,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 0.20 mol、0.60 mol、0.20mol | B. | 0.30 mol、0.60 mol、0.10 mol | ||
| C. | 0.40 mol、0.60 mol、0.10 mol | D. | 0.20 mol、0.10mol、0.60 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
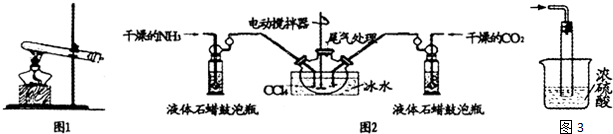
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
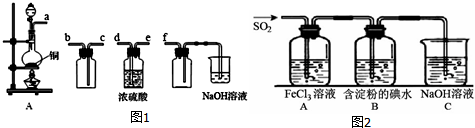
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
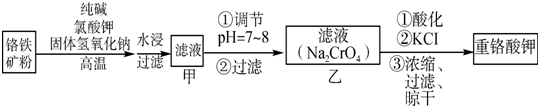
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=+242kJ•mol-1 | B. | 2H2(g)+O2(g)=2H2O(l)△H=+484kJ•mol-1 | ||
| C. | H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-242kJ•mol-1 | D. | 2H2(g)+O2(g)=2H2O(g)△H=-484kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
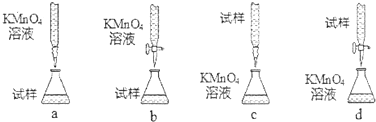
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
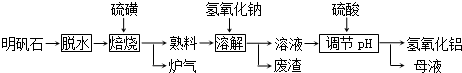
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com