
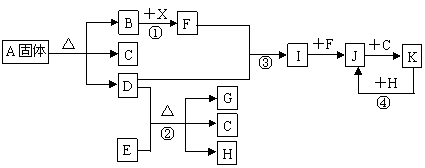
 ��ͼ��ʾ������֮���ת����ϵ����֪��������B��D��F��G��I��J�����壬 F��G�ǿ����е���Ҫ�ɷ֣�D��һ�ּ������塣A�����������Ӹ�������1��1�� E��һ�ֺ�ɫ�����H���Ϻ�ɫ�������ʡ�(����������ͷ�Ӧ����ʡ��)
��ͼ��ʾ������֮���ת����ϵ����֪��������B��D��F��G��I��J�����壬 F��G�ǿ����е���Ҫ�ɷ֣�D��һ�ּ������塣A�����������Ӹ�������1��1�� E��һ�ֺ�ɫ�����H���Ϻ�ɫ�������ʡ�(����������ͷ�Ӧ����ʡ��)
�밴Ҫ����գ�
��1��A���ʵĻ�ѧʽ�� �� ��
��2����Ӧ�۵Ļ�ѧ����ʽ�� �� ��
��Ӧ�ܵ����ӷ���ʽ�� �� ��
��3����Ӧ���в�����״����1.12L����F����ת�Ƶĵ�����Ŀ�� �� ��
��4��������ҺA�������ӵķ����� ��
��
��5����Ӧ������������ �� ��
 �ŵ������ϵ�д�
�ŵ������ϵ�д� 53������ϵ�д�
53������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ˮ����ԭ����������ԭ��Ӧ��(����)
A��������ˮ�ķ�Ӧ��Cl2��2H2OHCl��HClO
B��������ˮ�ķ�Ӧ��2F2��2H2O===4HF��O2
C�������ƺ�ˮ�ķ�Ӧ��CaO��H2O===Ca(OH)2
D�����ʳ��ˮ��2NaCl��2H2O 2NaOH��H2����Cl2��
2NaOH��H2����Cl2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���б仯�����У����ۼ����ƻ����ǣ� ��
A�ռ�����ˮ B�Ȼ�����������ˮ C������̼��ɸɱ� D�����ھƾ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���й�����û�з���������ԭ��Ӧ����
A. ��Ȼ��ȼ���ṩ����
B. ��ˮʹ��ɫֽ����ɫ
C. ������Ʒ�ڿ����б���ʴ
D����������ͨ��Ʒ����Һ�У���Һ��ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��NA��ʾ�����ӵ�������ֵ��������������ȷ����
A�����³�ѹ�£�6g H2O�к��е�ԭ����ĿΪNA
B����״���£�22.4LCO2���еķ�����ĿΪNA
C��1L1mol��L-1K2SO4��Һ�к��еļ�������ĿΪNA
D�����³�ѹ�£�11.2 L����������ͭ�۳�ַ�Ӧ��ת�Ƶĵ�����ΪNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ƽ����ϵ2NO+O2  2NO2��ͨ��18O��ɵ����������´ﵽƽ�����18O
2NO2��ͨ��18O��ɵ����������´ﵽƽ�����18O
A��ֻ������O2��
B��ֻ������NO2��
C��ֻ������O2��NO2��
D��������NO��O2��NO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ˮ�ĵ������ΪH2O H++OH-,��25�桢35��ʱ�����ӻ��ֱ�Ϊ
H++OH-,��25�桢35��ʱ�����ӻ��ֱ�Ϊ
K(25��)=1.0��10-14��K(35��)=2.1��10-14,������˵������ȷ����
A��ˮ�ĵ�����������ȹ���
B��c(H+)�����¶ȵĽ��Ͷ�����
C����35��ʱ����ˮ��c(H+)>c(OH-)
D��ˮ�ĵ���Ȧ�(25��)>��(35��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�ڿ��淴ӦN2+3H2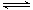 2NH3�У���ʾ�÷�Ӧ����������
2NH3�У���ʾ�÷�Ӧ����������
A��v(H2)=0.2 mol��L��1��min��1������ ������ B��v(N2)==0. 2 mol��L��1��min��1
C��v(NH3)=0.3 mol��L��1��min��1 ���� �� D��v(N2)==0. 004 mol��L��1��s��1
| �¶� | 350�� | 425�� | 490�� |
| ƽ�ⳣ�� | 66.9 | 54.4 | 45.9 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��NAΪ����٤������������������ȷ���� �� ��
A��1mol�״��к���C-H������ĿΪ4NA
B����״���£�2.24L���麬�з��ӵ���ĿΪ0.1NA
C��12�˽��ʯ�к��еĹ��ۼ���ĿΪ2NA
D��1 mol �������ĵ�����Ϊ10NA
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com