
已知NH4CuSO3与足量的10mol/L硫酸溶液混合微热,产生下列现象:
①有红色金属生成 ②产生刺激性气味的气体 ③溶液呈现蓝色。
据此判断下列说法正确的是
A.1mol NH4CuSO3完全反应转移0.5mol电子
B.NH4CuSO3中硫元素被氧化
C.刺激性气味的气体是氨气
D.反应中硫酸作氧化剂
科目:高中化学 来源:2016届陕西省高三上学期12月月考化学试卷(解析版) 题型:推断题
随着原子序数的递增,八种短周期元素原子半径的相对大小和最高正价或最低负价如图所示。
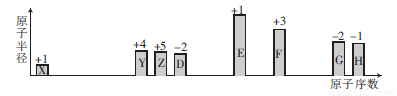
(1)元素Z位于元素周期表的第__________周期___________族,X与Z可形成18电子的化合物,该化合物的电子式为_______________。
(2)非金属性:Y___________(填“>”“<”或“=”)D。
(3)单质F与EDX溶液反应的化学化学方程式为____________________。
(4)G和H可形成一种化合物,其相对分子质量在90~110之间。且G的质量分数约为31.1%,该化合物的化学式为_________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北邯郸魏县一中、曲周县一中高一上期中化学试卷(解析版) 题型:选择题
下列物质溶于水,电离方程式错误的是
A.Na2CO3 Na+ + CO32- B.H2SO4
Na+ + CO32- B.H2SO4 2H++ SO42-
2H++ SO42-
C.MgCl 2
2 Mg2++2Cl- D.NaHSO4
Mg2++2Cl- D.NaHSO4 Na++H++ SO42-
Na++H++ SO42-
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北邯郸魏县一中、曲周县一中高二上期中化学试卷(解析版) 题型:选择题
化工生产中常用MnS作沉淀剂除去工业废水中的Cu2+:Cu2+(aq)+MnS(s) CuS(s)+Mn2+(aq),下列说法错误的是
CuS(s)+Mn2+(aq),下列说法错误的是
A.相同条件下,MnS的Ksp比CuS的Ksp大
B.该反应的平衡常数K=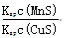
C.该反应达到平衡时c(Mn2+)=c(Cu2+)
D.往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省枣阳市高一上学期期中考试化学试卷(解析版) 题型:填空题
SO2和NOx都是大气污染物。
(1)直接排放含SO2的烟气会形成酸雨,危害环境。用化学方程式表示SO2形成硫酸型酸雨的过程 。
(2)右表是某小组同学测得的不同天气情况下的某县城空气中SO2的平均含量。请你分析雨后或风速较大时SO2平均含量较低的原因:
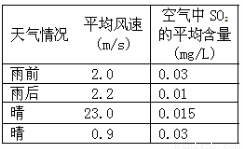
①雨后:_________________;
②风速较大时:____________________。
(3)洗涤含SO2的烟气。以下物质不能作为洗涤剂的是________(填字母序号)。
a.熟石灰 b.纯碱 c.CaCl2 d.NaHSO3
(4)煤燃烧前需进行脱硫处理,某种脱硫技术的基本原理如下:
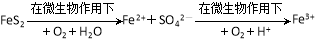
①该技术的第一步反应的离子方程式为 。
②处理1 kg含80% FeS2的黄铁矿,第二步消耗O2(标况)的体积为 L(保 留一位小数)。
留一位小数)。
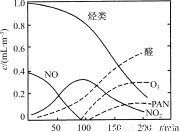
(5)某研究性学习小组为模拟光化学烟雾的形成,用紫外线照射装在密闭容器内的被污染空气样品,所得物质的浓度随时间的变化如图所示。由图可知,光化学烟雾是指等污染物气体和颗粒物所形成的烟雾。
(6)氧化—还原法消除NOx的转化如下:
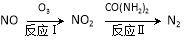
①反应Ⅰ为NO+O3=NO2 +O2,生成11.2 L O2(标况)时,转移电子的物质的量是 mol。
+O2,生成11.2 L O2(标况)时,转移电子的物质的量是 mol。
②反应Ⅱ中,反应的化学方程式是 。
(7)利用氨水可以将SO2和NO2吸收,原理如下图所示:

NO2被吸收的离子方程式是 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省枣阳市高一上学期期中考试化学试卷(解析版) 题型:选择题
下列分子或离子在无色透明的溶液中能大量共存的是
A.Na+、 H+、SO32-、HClO B.Al3+、Mg2+、OH-、CO32-
H+、SO32-、HClO B.Al3+、Mg2+、OH-、CO32-
C.K+、OH-、Cl-、NH3·H2O D.Ba2+、Fe3+、NO3-、Cl-
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省枣阳市高一上学期期中考试化学试卷(解析版) 题型:选择题
下列离子方程式正确的是
A.醋酸溶液与水垢中的CaCO3反 应:CaCO3+2H+=Ca2++H2O+CO2
应:CaCO3+2H+=Ca2++H2O+CO2 
B.FeCl3溶液与Cu的反应:Cu+Fe3+=Cu2++Fe2+
C.向Ba(OH)2溶液中滴加NaHSO4溶液至混合溶液恰好为中性:Ba2++OH-+H++SO42-=BaSO4 +H2O
+H2O
D.用小苏打类药物治疗胃酸过多:HCO3-+H+=CO2 +H2O
+H2O
查看答案和解析>>
科目:高中化学 来源:2016届北京一五六中学上学期高三期中考试化学试卷(解析版) 题型:实验题
某小组同学为比较酸性条件下NO3-、SO42-、Fe3+的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。
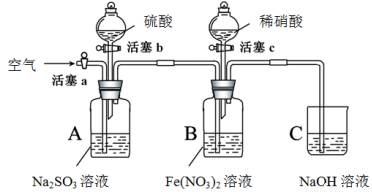
实验记录如下:
实验操作 | 实验现象 | |
I | 打开活塞c,将过量稀HNO3加入装置B中,关闭活塞c | B中浅绿色溶液立即变为深棕色;一段时间后,溶液最终变为黄色。 |
II | 用注射器取出少量B装置中的溶液,加入KSCN溶液 | 溶液变为红色。 |
III | 打开活塞b,向A装置中加入足量硫酸,关闭活塞b | A中产生气体;B中有气泡,液面上有少量红棕色气体生成。 |
IV | 一段时间后,用注射器取出少量B装置中的溶液,…… | …… |
V | 打开活塞a,通入一段时间空气 | ———— |
请回答下列问题:
(1)保存Fe(NO3)2溶液时,常加入铁粉,目的是(用化学方程式表示)________。
(2)实验I中,发生反应的离子方程式是________。
(3)资料表明,Fe2+能与NO结合形成深棕色物质[Fe(NO)]2+: Fe2+ + NO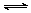 [Fe(NO)]2+
[Fe(NO)]2+
用平衡移动原理解释实验I中溶液由深棕色变为黄色的原因是________________________。
(4)分析实验现象,同学们得出了结论。则:
① 实验IV的后续操作是________________,观察到的现象是________________。
② 由实验得出的结论是_______________________。
(5)实验反思
① 实验操作V的目的是_______________________________________。
② 实验操作III,开始时B中溶液的颜色并无明显变化,此时溶液中发生反应的离子方程式是________。
③ 有同学认为装置中的空气会干扰实验结论的得出,应在实验前通一段时间的氮气。你是否同意该看法,理由是________________________________________。
查看答案和解析>>
科目:高中化学 来源:2016届北京东城(南区)重点中学高三第一学期课堂综合练习化学试卷(解析版) 题型:选择题
在1000 mL含有等物质的量的HBr和H2SO3溶液中通入0.01 molCl2,有一半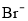 变为Br2,原溶液中HBr和H2SO3的浓度都等于
变为Br2,原溶液中HBr和H2SO3的浓度都等于
A.0.007 5 mol·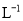 B.0.008 mol·
B.0.008 mol·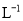 C.0.075 mol·
C.0.075 mol·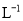 D.0.08 mol·
D.0.08 mol·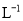
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com