


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
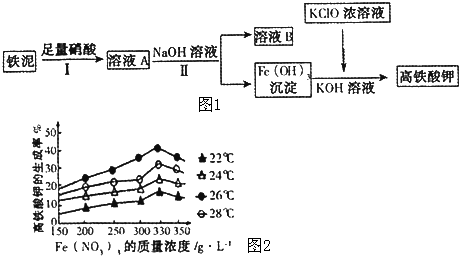
查看答案和解析>>
科目:高中化学 来源: 题型:
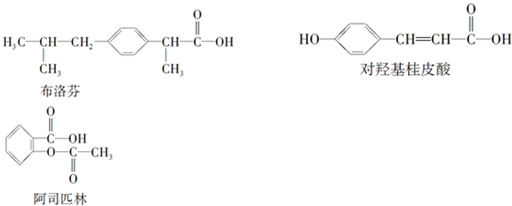
| A、三种有机物都能发生水解反应 |
| B、使用FeCl3溶液和稀硫酸可以鉴别这三种有机物 |
| C、三种有机物苯环上的氢原子若被氯原子取代,其一氯代物都只有2种 |
| D、将等物质的量的三种物质加入氢氧化钠溶液中,对羟基桂皮酸消耗氢氧化钠最多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 操作 | 现象 | 结论 | |
| A | 向无色溶液中滴加氯水和CCl4,振荡、静置 | 下层溶液显紫色 | 原溶液中有I- |
| B | 向Na2CO3饱和溶液中通入足量CO2 | 溶液变浑浊 | 析出了NaHCO3 |
| C | 将少量氯气通入FeI2中 | 浅绿色变为棕黄色 | 2Fe2++Cl2=2Fe3++2Cl- |
| D | 过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀HNO3将Fe氧化为Fe3+ |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、BaCl2溶液 |
| B、FeCl2溶液 |
| C、FeCl3溶液 |
| D、NaNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1000mL,212g |
| B、950mL,100.7g |
| C、任意规格,572g |
| D、500mL,286g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钢 | B、纯铁 | C、碳 | D、无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO2的水溶液能导电说明SO2是电解质 |
| B、某溶液加NaOH溶液加热,产生气体使湿润红色石蕊试纸变蓝,则该溶液含有NH4+ |
| C、HClO是弱酸,所以NaClO是弱电解质 |
| D、某溶液中加入盐酸能产生使澄清石灰水变浑浊气体,则该溶液一定存在大量CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com