
【题目】用含有Al2O3、SiO2和少量FeO·xFe2O3的铝灰制备Al2(SO4)3·18H2O,工艺流程如下(部分操作和条件略):
Ⅰ. 向铝灰中加入过量稀H2SO4,过滤;
Ⅱ. 向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ. 加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;
Ⅳ. 加入MnSO4至紫红色消失,过滤;
Ⅴ. 加热浓缩、冷却结晶、过滤、洗涤、干燥,得到产品。
(1)H2SO4溶解Al2O3的离子方程式是__________________。
(2)KMnO4氧化Fe2+的离子方程式补充完整:_________________

(3)已知:生成氢氧化物沉淀的pH
Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
开始沉淀时 | 3.4 | 6.3 | 1.5 |
完全沉淀时 | 4.7 | 8.3 | 2.8 |
注:金属离子的起始浓度为0.1mol·L-1
根据表中数据解释步骤Ⅱ的目的_______________;
(4)已知:一定条件下,MnO4-可与Mn2+反应生成MnO2,
①向Ⅲ的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是____________。
②Ⅳ中加入MnSO4的目的是_____________________。
【答案】 Al2O3+6H+=2Al3++3H2O 5 8H+ 5 4H2O pH约为3时,Fe2+和Al3+不能沉淀,将Fe2+氧化成Fe3+,可使Fe元素沉淀完全 生成黄绿色气体 除去过量的高锰酸根
【解析】(1)硫酸溶解氧化铝生成硫酸铝和水,反应的离子方程式为:Al2O3+6H+=2Al3++3H2O;(2)高锰酸根离子在酸溶液中被还原为锰离子,亚铁离子被氧化为铁离子,反应的离子方程式为:MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O,故答案为:1、5;8H+;1、5;4H2O;(3)向滤液中加入过量KMnO4溶液,目的是氧化亚铁离子为三价铁离子,依据图表数据分析可知,铁离子开始沉淀和沉淀完全的溶液pH为1.5--2.8,铝离子和亚铁离子开始沉淀的溶液pH大于3,所以调节溶液的pH约为3,可以使铁离子全部沉淀,铝离子不沉淀分离;故答案为:pH约为3时,Fe2+和Al3+不能形成沉淀,将Fe2+氧化为Fe3+,可使铁完全沉淀;(4)一定条件下,MnO4-可与Mn2+反应生成MnO2,①向Ⅲ的沉淀中加入浓HCl并加热,二氧化锰和浓盐酸在加热条件下反应生成氯化锰、氯气和水,生成的氯气是黄绿色气体,能说明沉淀中存在MnO2的现象是生成黄绿色气体;②MnO4-可与Mn2+反应生成MnO2,过滤除去,所以可以利用MnSO4的溶液和高锰酸钾溶液反应生成二氧化锰,把过量高锰酸根离子除去;


科目:高中化学 来源: 题型:
【题目】N2H4通常用作火箭的高能燃料,N2O4作氧化剂.请回答下列问题:
(1)已知:N2(g)+2O2(g)═2NO2(g)△H=+a kJ/mol
N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=﹣b kJ/mol
2NO2(g)N2O4(g)△H=﹣c kJ/mol
写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式 .
(2)N2、H2合成氨气为放热反应.800K时向下列起始体积相同的密闭容器中充入2molN2、3molH2 , 甲容器在反应过程中保持压强不变,乙容器保持体积不变,丙是绝热容器,三容器各自建立化学平衡.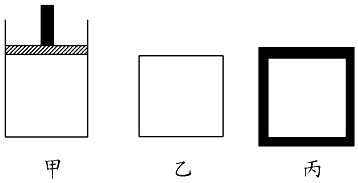
①达到平衡时,平衡常数K甲K乙K丙(填“>”、“<”或“=”).
②达到平衡时N2的浓度c(N2)甲c(N2)乙,c(N2)乙c(N2)丙(填“>”、“<”或“=”).
③对甲、乙、丙三容器的描述,以下说法正确的是 .
A.乙容器气体密度不再变化时,说明此反应已达到平衡状态
B.在甲中充入稀有气体He,化学反应速率加快
C.向甲容器中充入氨气,正向速率减小,逆向速率增大
D.丙容器温度不再变化时说明已达平衡状态.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示进行实验,下列说法不正确的是
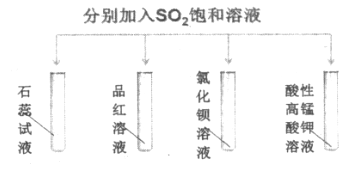
A. 石蕊试液变红说明SO2的水溶液显酸性
B. 品红溶液、酸性高锰酸钾溶液褪色原因不相同
C. BaCl2溶液中开始没有明显现象,一段时间后缓慢出现浑浊,该浑浊为BaSO3
D. 该实验说明SO2的性质具有多样性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产硫酸的流程如下图所示。己知黄铁矿的主要成分是FeS2(二硫化亚铁)。

请回答下列问题:
(1)FeS2中铁元素的化合价是_____________。
(2)接触室中生成SO3的化学方程式是_____________________。
(3)从接触室中出来并被循环利用的物质是______________________。
(4)工业上采用氨水处理尾气中的SO2,请写出足量氨水和SO2反应的离子方程式____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】手术用器械抗菌消毒剂OPA可由烃A合成,根据下图的转化关系回答下列问题:
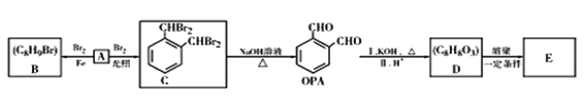
已知:
①两个羟基连在同一个碳上不稳定,易脱去一个水分子,如:
②无α-H(醛基相邻碳上的氢)的醛能发生歧化反应,如:2HCHO+KOH→CH3OH+HCOOK
(1)A的化学名称为_____________________。
(2)A→B的反应类型为__________________。
(3)D中所含官能团的名称为_________、_________。
(4)由2个D分子在浓硫酸加热条件下能生成一个环状有机化合物,其结构简式为_____________________________,反应类型为___________。
(5)E是一种聚酯类高分子化合物,由D生成E的化学方程式为____________________。
(6)D的同分异构体中,同时满足下列条件的有_____种,其中核磁共振氢谱只有4组峰的是__________________(填结构简式)。
①苯环上只有两个取代基 ②可发生水解反应
③1mol D最多可与3mol NaOH反应 ④不含“![]() ”结构
”结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年中国首次海域可燃冰(CH4·nH2O,密度ρ1 g·cm-3)试开采成功。若以辛烷代表汽油(密度ρ2 g·cm-3)的组成,下列说法不正确的是
① CH4(g) + 2O2(g) =CO2(g) + 2H2O(l) ΔH1 = —a kJ·mol-1
② 2C8H18(l) + 25O2(g) =16CO2 (g) + 18H2O(l) ΔH 2 = —b kJ·mol-1
A. 可燃冰适宜保存在低温,高压的环境中
B. 1 m3可燃冰可释放出标准状况下![]() m3的CH4
m3的CH4
C. 汽油的燃烧热约为0.5b kJ·mol-1
D. 1m3可燃冰释放出的甲烷燃烧放出的热量约为等体积汽油的![]() 倍
倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据合成氨反应的能量变化示意图,下列有关说法正确的是

A. N2(g)+3H2(g)=2NH3(g) △H=-2(a-b)kJ·mol-1
B. 断裂0.5moIN2 (g)和1.5molH2(g)中所有的化学键释放akJ热量
C. 2NH3 (l)= N2(g)+3H2(g) △H=2(b+c-a) kJ·mol-1
D. 若合成氨反应使用催化剂,反应放出的热量增多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Na+浓度为1.0 molL-1的某澄清溶液中,还可能含有K+、Mg2+、Fe3+、Ba2+、CO32-、SO32-、SiO32-、Cl-、SO42-等离子,取该溶液100mL 进行下图连续实验(所加试剂均过量,气体全部逸出)。下列说法不正确的是

A. 原溶液中一定不存在Mg2+、Fe3+、Ba2+、SO42-
B. 在l00mL原溶液中加入足量BaCl2溶液,至少可生成沉淀20.5g
C. 为确定原溶液中是否含有Cl-,可取滤液C,加入AgNO3和稀HNO3溶液
D. 原溶液一定存在K+,c(K+)可能为1.5 molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】火法炼汞是在不太高的温度下(450~800℃),将汞矿石或精矿进行焙烧,直接将汞还原呈气态分离出来,而后冷凝成液态汞.目前工业上制粗汞的流程如图:

下列有关说法正确的是( )
A. 流程中加入氧化钙的目的是减少SO2的排放
B. “辰砂”加热时发生反应:HgS+O2 ![]() Hg+SO2,该方法属于热分解法
Hg+SO2,该方法属于热分解法
C. 洗涤粗汞时可用5%的盐酸代替5%的硝酸
D. 含汞烟气中汞的含量很低,可以直接排放
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com