
【题目】氯化镁纯品为无色单斜晶体,工业品通常呈黄褐色,有苦咸味。该物质可以形成六水合物,即六水氯化镁(MgCl2·6H2O),以下流程为由某混合物,制取纯净MgCl2·6H2O的生产过程:

已知:在本流程中,
Fe3+ | Fe2+ | Al3+ | Mg2+ | |
开始沉淀pH | 1.5 | 6.5 | 3.3 | 8.4 |
完全沉淀pH | 4.1 | 9.7 | 5.5 | 10.9 |
试回答下列问题:
(1)操作1所需玻璃仪器为____________________。
(2)流程中加入试剂2调节pH的范围是________;加入试剂2能形成沉淀的原因是___________________。
(3)操作3为加入足量的盐酸,然后经过___________、____________,过滤,洗涤,干燥;在操作不当的情况下,若MgCl2·6H2O受热则会发生水解形成碱式盐,则该反应的化学方程式为____________________。
(4)若25℃下,Ksp[Mg(OH)2]=4×10-12,则该温度下,将Mg(OH)2溶于水形成饱和溶液,则其饱 和溶液的pH=_________。(已知:lg5=0.7)
【答案】烧杯、漏斗、玻璃棒 5.5≤pH<8.4 试剂2与H+反应,使溶液的pH 值升高,促进了Al3+、Fe3+的水解,完全水解生成Fe(OH)3和Al(OH)3 蒸发浓缩 冷却结晶 MgCl2·6H2O![]() Mg(OH)Cl+HCl↑+5H2O 10.3
Mg(OH)Cl+HCl↑+5H2O 10.3
【解析】
固体混合物溶于盐酸得到氯化镁、氯化铝、氯化铁、氯化亚铁和盐酸的混合液,二氧化硅不溶,因此过滤得到的滤渣1是二氧化硅,滤液1中加入过氧化氢将溶液中的亚铁离子氧化为铁离子,通过调节pH得到氢氧化铝和氢氧化铁,滤液3中含有氯化镁,经过操作3得到MgCl2·6H2O,据此解答。
(1)操作1是过滤,所需玻璃仪器为烧杯、漏斗、玻璃棒。
(2)流程中加入试剂2调节pH时得到氢氧化铁和氢氧化铝沉淀,镁离子不沉淀,因此根据表中数据,范围是5.5≤pH<8.4;加入试剂2能形成沉淀的原因是试剂2与H+反应,使溶液的pH值升高,促进了Al3+、Fe3+的水解,完全水解生成Fe(OH)3和Al(OH)3沉淀。
(3)操作3得到MgCl2·6H2O,由于镁离子水解,则操作为加入足量的盐酸,然后经过蒸发浓缩、冷却结晶,过滤,洗涤,干燥;在操作不当的情况下,若MgCl2·6H2O受热则会发生水解形成碱式盐,则该反应的化学方程式为MgCl2·6H2O![]() Mg(OH)Cl+HCl↑+5H2O。
Mg(OH)Cl+HCl↑+5H2O。
(4)若25℃下,Ksp[Mg(OH)2]=4×10-12,则该温度下,将Mg(OH)2溶于水形成饱和溶液,设其饱和溶液中氢氧根的浓度是x mol/L,则0.5x×x2=4×10-12,解得x=2×10-4,氢离子浓度是5×10-11 mol/L,所以溶液的pH=10.3。


科目:高中化学 来源: 题型:
【题目】国际计量大会新修订了阿伏加德罗常数(NA=6.02214076×1023mol1),并于2019年5月20日正式生效。下列有关NA说法正确的是
A.22.4LCH2=CHCH3分子中含碳碳双键的数目为NA
B.1mol羟基(﹣OH)所含的电子总数为9NA
C.常温常压下,14g聚乙烯含有原子总数为3NA
D.64 g S2和S8混合物中含硫原子总数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中必定伴随着能量变化,通常表现为热量的变化——放热或者吸热。其中有些放热的化学反应通过原电池装置可以转化为电能。
Ⅰ.已知H2(g)+![]() O2(g)=H2O(g),如图是1molH2燃烧的反应过程中能量变化示意图。请回答下列问题:
O2(g)=H2O(g),如图是1molH2燃烧的反应过程中能量变化示意图。请回答下列问题:

(1)该反应是______(填“吸热”或“放热”)反应。
(2)氢气在氧气中燃烧,破坏1molH—H键吸收Q1kJ的能量,破坏1molO=O键吸收Q2kJ的能量,形成1molH—O键释放Q3kJ的能量,则下列关系式正确的是_______。
A.2Q1+Q2>4Q3 B.2Q1+Q2<4Q3
C.Q1+Q2<Q3 D.2Q1+Q2=4Q3
Ⅱ.如图为原电池装置示意图:

(3)若A为铜片,B为铁片,电解质为FeCl3溶液,则铁片为____极(填“正”或“负”),写出正极反应式__________。
(4)若A、B均为铂片,电解质为KOH溶液,分别从A、B两极通入H2和O2,该电池即为燃料电池,通入氧气的一极为该电池的____极(填“正”或“负”),写出该电池的负极反应式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以NOx为主要成分的雾霾的综合治理是当前重要的研究课题。
I. N2O是一种强温室气体,且易形成颗粒性污染物,研究N2O的分解对环境保护有重要意义。
(1) 碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步I2(g)2I(g)(快反应)
第二步I(g)+N2O(g)→N2(g)+IO(g)(慢反应)
第三步IO(g)+N2O(g)→N2(g)+O2(g)+I2(g)(快反应)
实验表明,含碘时N2O分解速率方程v=k·c(N2O)·[c(I2)]0.5(k为速率常数)。下列表述正确的是__________。
A.N2O分解反应中:k值与是否含碘蒸气有关 B.第三步对总反应速率起决定作用
C.第二步活化能比第三步小 D.IO为反应的催化剂
Ⅱ.汽车尾气中含有较多的氮氧化物和不完全燃烧的CO,汽车三元催化器可以实现降低氮氧化物的排放量。汽车尾气中的NO(g)和CO(g)在催化剂的作用下转化成两种无污染的气体。如,
反应I:2CO +2NO N2+2CO2 △H1;反应II:4CO +2NO2 N2+4CO2 △H2<0。
(2) 针对反应I:
①已知:反应N2(g)+O2(g)2NO(g) △H3=+180.0kJ·mol1,若CO的燃烧热为-283.5kJ·moll 则反应I的△H1=_________kJ·mol1。
②若在恒容的密闭容器中,充入2molCO和1molNO,发生反应I,下列选项中不能说明该反应已经达到平衡状态的是_______。
A.CO和NO的物质的量之比不变 B.混合气体的密度保持不变
C.混合气体的压强保持不变 D.2v(N2)正=v(CO)逆
(3) 在2L密闭容器中充入2 mol CO和1 molNO2,发生上述反应II。
①若在某温度下,该反应达平衡时CO的转化率为40%,则该反应的平衡常数为________。
图 1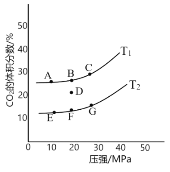 图 2
图 2 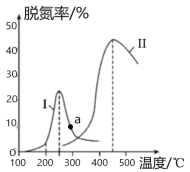
②图1为平衡时CO2的体积分数与温度、压强的关系。则温度:T1____T2(填“<”或“>”);若 在D点对反应容器升温的同时扩大体积使体系压强减小,重新达到的平衡状态可能是图中A~G点中的____点。
(4) 某研究小组探究催化剂对CO、NO2转化的影响。将NO2和CO以一定的流速通过两种不同的 催化剂进行反应,相同时间内测量逸出气体中NO2含量,从而确定尾气脱氮率(脱氮率即NO2的转化率),结果如图2所示。若高于450℃,图2中曲线中脱氮率随温度升高而降低的主要 原因是___________________________;a点 ______________(填“是”或“不是”)对应温度下的平衡脱氮率,说明理由____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组的甲、乙同学分别设计了以下实验来验证元素周期律。
(Ⅰ)甲同学在 a、b、c 三只烧杯里分别加入 50 mL 水,再分别滴加几滴酚酞溶液,依次加入 大小相近的锂、钠、钾块,观察现象。
①甲同学设计实验的目的是______
②反应最剧烈的烧杯是______(填字母);
③写出 b 烧杯里发生反应的离子方程式______
(Ⅱ)乙同学设计了下图装置来探究碳、硅元素的非金属性强弱,根据要求完成下列各小题
(1)实验装置:

(2)实验步骤: 连接仪器、______、加药品后,打开 a、然后滴入浓硫酸,加热。
(3)问题探究:(已知酸性强弱:亚硫酸>碳酸)
①铜与浓硫酸反应的化学方程式是______,装置 E 中足量酸性 KMnO4 溶液 的作用是______。
②能说明碳元素的非金属性比硅元素非金属性强的实验现象是______;
③试管 D 中发生反应的离子方程式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)在200℃、101kPa时,0.5molH2(g)与足量I2(g)完全反应放出7.45kJ的热量,该反应的热化学方程式表示为____。
(2)根据键能数据估算
化学键 | C—H | C—F | H—F | F—F |
键能/(kJ·mol-1) | 414 | 489 | 565 | 155 |
CH4(g)+4F2(g) =CF4(g)+4HF(g)的反应热ΔH为______kJ/mol
(3) 已知:①2CH3OH(l)+3O2(g) =2CO2(g)+4H2O(g) ΔH1=-a kJ/mol
②C(s)+O2(g)=CO2(g) ΔH2=-b kJ/mol
③2H2(g) + O2(g) = 2H2O(g) ΔH3 = -c kJ/mol
a、b、c均大于0 则:反应①中,ΔS______(选填“>”、“<”或“=”)0;
2C(s)+4H2(g)+O2(g) = 2CH3OH(l) ΔH=_______kJ/mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用无机矿物资源生产部分材料的流程示意图如下。下列说法不正确的是( )

A. 在铝土矿制备较高纯度Al的过程中常用到NaOH溶液、CO2气体、冰晶石
B. 石灰石、纯碱、石英、玻璃都属于盐,都能与盐酸反应
C. 在制粗硅时,被氧化的物质与被还原的物质的物质的量之比为2∶1
D. 黄铜矿(CuFeS2)与O2反应产生的Cu2S、FeO均是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某离子反应中涉及![]() 六种微粒,其中
六种微粒,其中![]() 的物质的量随时间变化的曲线如图所示。下列判断正确的是( )
的物质的量随时间变化的曲线如图所示。下列判断正确的是( )
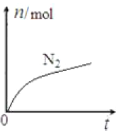
A.该反应的氧化剂是![]() ,还原产物是
,还原产物是![]() B.消耗
B.消耗![]() 还原剂,转移
还原剂,转移![]() 电子
电子
C.氧化剂与还原剂的物质的量之比为![]() D.水是生成物,且反应后溶液的酸性明显增强
D.水是生成物,且反应后溶液的酸性明显增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气是城市空气污染来源之一,汽车尾气中含有CO和NO等有害物质。通过特殊的催化装置,可以使CO与NO相互反应生成无害且稳定的气体N2和CO2,反应的化学方程式是:____________ 。其中氧化剂是 _______ ,还原剂是 _________ ,电子由 ________ 原子转移到 ____________ 原子。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com