
| A. | 当a:b>2时,发生的离子反应为:2OH-+CO2═CO32-+H2O | |
| B. | 当a:b<1时,发生的离子反应为:OH-+CO2═HCO3- | |
| C. | 当2a=3b时,发生的离子反应为:2OH-+CO2═CO32-+H2O | |
| D. | 当0.5a<b<a时,溶液中HCO3-与CO32-共存 |
分析 由NaOH、CO2的物质的量比1:1时发生OH-+CO2═HCO3-,1:2时发生2OH-+CO2═CO32-+H2O,可知二氧化碳不足生成碳酸钠,二氧化碳过量生成碳酸氢钠,若a:b介于1:1与1:2时生成碳酸钠、碳酸氢钠,以此来解答.
解答 解:A.当a:b>2时,NaOH过量,生成碳酸钠,则发生的离子反应为2OH-+CO2═CO32-+H2O,故A正确;
B.当a:b<1时,NaOH不足,生成碳酸氢钠,则发生的离子反应为OH-+CO2═HCO3-,故B正确;
C.当2a=3b时,a:b介于1:1与1:2时生成碳酸钠、碳酸氢钠,则发生的离子反应为3OH-+2CO2═CO32-+HCO3-+H2O,故C错误;
D.当0.5a<b<a时,a:b介于1:1与1:2时生成碳酸钠、碳酸氢钠,则溶液中HCO3-与CO32-共存,故D正确;
故选C.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重与量有关的离子反应考查,注意物质的量关系及电荷守恒,题目难度不大.


 星级口算天天练系列答案
星级口算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 甲烷和氯气混合并光照 | B. | 乙醇和酸性高锰酸钾溶液的反应 | ||
| C. | 乙烯生成聚乙烯 | D. | 苯和氢气反应生成环己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | R一定是氧元素 | B. | R的最高价氧化物为RO2 | ||
| C. | R的气态氢化物很稳定 | D. | R可以形成多种含氧酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(B2)=0.8 mol•L-1•s-1 | B. | v(A2)=0.4 mol•L-1•s-1 | ||
| C. | v(C)=0.6 mol•L-1•s-1 | D. | v(B2)=1.8 mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正反应速率等于逆反应速率 | B. | 各组分浓度不再发生变化 | ||
| C. | 反应体系中某组分的组成保持不变 | D. | 正、逆反应速率都为零 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
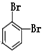 和
和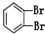 ④CH4和CH3CH2CH3; ⑤葡萄糖与果糖;⑥16O和18O.
④CH4和CH3CH2CH3; ⑤葡萄糖与果糖;⑥16O和18O.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
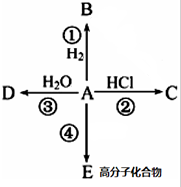 某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A在一定条件下课发生如图所示的转化,请回答下列问题.
某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A在一定条件下课发生如图所示的转化,请回答下列问题. ,D中所含的官能团为羟基.
,D中所含的官能团为羟基.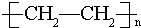 ,反应类型为加聚反应.
,反应类型为加聚反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素的性质随着相对原子质量的递增而呈周期性变化 | |
| B. | 第三周期元素的最高正化合价等于它所处的主族序数 | |
| C. | 短周期元素形成离子后,最外层电子都达到8电子稳定结构 | |
| D. | 同一主族的元素的原子,最外层电子数相同,化学性质完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
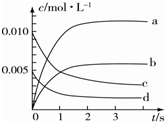 在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表所示:
在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表所示:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com