
【题目】X、Y、Z、W、R、I、Q为前30号元素,且原子序数依次增大.X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,I的原子序数是W的两倍,Q的最外层只有一个电子,其他电子层电子均处于饱和状态.请回答下列问题:
(1)Q+核外电子排布式为___________,Y的电子排布图为_________________________
(2)化合物ZX3中Z原子的杂化方式为___________,ZW2- 离子的立体构型是___________;
(3)①Y、R的最高价氧化物的沸点较高的是___________(填化学式),原因是___________;
②W与I的简单氢化物中W的熔沸点更高,原因是______________________
(4)向Q元素的硫酸盐溶液中通入足量ZX3,充分反应后溶液呈深蓝色,该反应的离子方程式为__________________________________________________;
(5)Y有多种同素异形体,其中一种同素异形体的晶胞结构如图,该晶体一个晶胞的Y原子数为___________,Y原子的配位数为___________,若晶胞的边长为a pm,晶体的密度为ρ g/cm3,则阿伏加德罗常数的数值为___________(用含a和ρ的代数式表示)。

【答案】1s22s22p63s23p63d10 ![]() sp3 V形 SiO2 SiO2为原子晶体,CO2为分子晶体 水分子间存在氢键 Cu2+ + 4NH3= [Cu(NH3)4]2+或Cu2+ + 4NH3·H2O= [Cu(NH3)4]2++ 4H2O 8 4
sp3 V形 SiO2 SiO2为原子晶体,CO2为分子晶体 水分子间存在氢键 Cu2+ + 4NH3= [Cu(NH3)4]2+或Cu2+ + 4NH3·H2O= [Cu(NH3)4]2++ 4H2O 8 4 ![]()
【解析】
X是所有元素中原子半径最小的,X为H元素;Y有三个能级,且每个能级上的电子数相等,Y为C元素;R与Y同一主族且原子序数小于30,则R为Si元素;X、Y、Z、W、R、I、Q的原子序数依次增大,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,Z为N元素,W为O元素;I的原子序数是W的两倍,I为S元素;Q的最外层只有一个电子,其他电子层电子均处于饱和状态,Q为Cu元素。
(1)根据构造原理书写电子排布式和电子排布图。
(2)用价层电子对互斥理论判断杂化方式和空间构型。
(3)①Y、R的最高价氧化物分别为CO2、SiO2,CO2属于分子晶体,SiO2属于原子晶体,沸点:CO2<SiO2。
②W、I的简单氢化物分别为H2O、H2S,H2O的熔沸点比H2S高的原因是:H2O分子间存在氢键,H2S分子间不存在氢键。
(4)向CuSO4溶液中通入足量NH3,生成的深蓝色离子为[Cu(NH3)4]2+。
(5)用“均摊法”确定晶胞中原子数。由晶胞可看出配位数为4。根据晶体的密度计算1mol晶体的体积,晶胞边长计算晶胞体积,结合晶胞中原子数计算阿伏加德罗常数。
X、Y、Z、W、R、I、Q为前30号元素,且原子序数依次增大.X是所有元素中原子半径最小的,X为H元素;Y有三个能级,且每个能级上的电子数相等,Y为C元素;R与Y同一主族且原子序数小于30,则R为Si元素;X、Y、Z、W、R、I、Q的原子序数依次增大,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,Z为N元素,W为O元素;I的原子序数是W的两倍,I为S元素;Q的最外层只有一个电子,其他电子层电子均处于饱和状态,Q为Cu元素。
(1)Q为Cu,Cu原子核外有29个电子,根据构造原理,基态Cu原子的核外电子排布式为1s22s22p63s23p63d104s1,Cu+的核外电子排布式为1s22s22p63s23p63d10;Y为C,基态C原子的核外电子排布式为1s22s22p2,电子排布图为![]() 。
。
(2)化合物ZX3为NH3,中心原子N的价层电子对数为![]() ×(5-3×1)+3=4,N原子为sp3杂化。ZW2-为NO2-,NO2-中中心原子N上的孤电子对数为
×(5-3×1)+3=4,N原子为sp3杂化。ZW2-为NO2-,NO2-中中心原子N上的孤电子对数为![]() ×(5+1-2×2)=1,σ键电子对数为2,N的价层电子对数为3,VSEPR模型为平面三角形,由于N上有1对孤电子对,NO2-的立体构型为V形。
×(5+1-2×2)=1,σ键电子对数为2,N的价层电子对数为3,VSEPR模型为平面三角形,由于N上有1对孤电子对,NO2-的立体构型为V形。
(3)①Y、R的最高价氧化物分别为CO2、SiO2,沸点较高的是SiO2,原因是:CO2属于分子晶体,SiO2属于原子晶体,分子间作用力远小于共价键的键能,所以沸点:CO2<SiO2。
② W、I的简单氢化物分别为H2O、H2S,H2O的熔沸点比H2S高的原因是:H2O分子间存在氢键,H2S分子间不存在氢键。
(4)向CuSO4溶液中通入足量NH3,生成的深蓝色离子为[Cu(NH3)4]2+,反应的离子方程式为Cu2++4NH3=[Cu(NH3)4]2+或Cu2++4NH3·H2O=[Cu(NH3)4]2++4H2O。
(5)Y为C元素,用“均摊法”,1个晶胞中含C原子数:8×![]() +6×
+6×![]() +4=8个;根据晶胞,C原子周围等距离最近的C原子有4个,C原子的配位数为4;1molC的质量为12g,1mol该晶体的体积为
+4=8个;根据晶胞,C原子周围等距离最近的C原子有4个,C原子的配位数为4;1molC的质量为12g,1mol该晶体的体积为![]() =
=![]() cm3,晶胞的边长为apm,晶胞的体积为(a×10-10cm)3=a3×10-30cm3,则阿伏加德罗常数的数值为
cm3,晶胞的边长为apm,晶胞的体积为(a×10-10cm)3=a3×10-30cm3,则阿伏加德罗常数的数值为![]() cm3÷(a3×10-30cm3÷8)=
cm3÷(a3×10-30cm3÷8)=![]() ×1030。
×1030。


科目:高中化学 来源: 题型:
【题目】氢氧燃料电池,是一种高效无污染的清洁电池,它分碱性(用KOH做电解质)和酸性(用硫酸做电解质)氢氧燃料电池,下图是氢氧燃料电池。
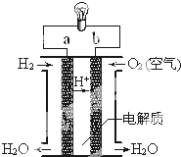
(1)该电池的负极是通_____(填通入的气体)。
(2)如果是碱性燃料电池则负极反应方程式是:___________。
(3)如果是酸性燃料电池则正极极反应方程式是:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列酸与碱中和反应热化学方程式可用:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1来表示的是(Q1,Q2,Q3,Q4都大于0) ( )
A. CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l) ΔH=-Q1 kJ·mol-1
B. ![]() H2SO4(浓)+NaOH(aq)=
H2SO4(浓)+NaOH(aq)=![]() Na2SO4(aq)+H2O(l) ΔH=-Q2 kJ·mol-1
Na2SO4(aq)+H2O(l) ΔH=-Q2 kJ·mol-1
C. HNO3(aq)+NaOH(aq)=NaNO3(aq)+H2O(l) ΔH=-Q3 kJ·mol-1
D. ![]() H3PO4(aq)+
H3PO4(aq)+![]() Ba(OH)2(aq)=
Ba(OH)2(aq)= ![]() Ba3(PO4)2(s)+H2O(l) ΔH=-Q4 kJ·mol-1
Ba3(PO4)2(s)+H2O(l) ΔH=-Q4 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关一定物质的量浓度溶液的配制说法中正确的是 ( )
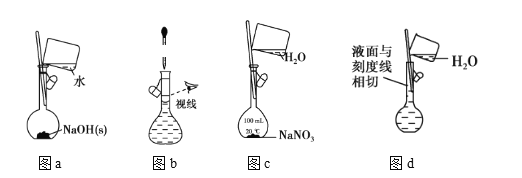
(1)为准确配制一定物质的量浓度的溶液,定容过程中向容量瓶内加蒸馏水至接近刻度线时,改用胶头滴管滴加蒸馏水至刻度线
(2)利用图a配制0.10molL-1NaOH溶液
(3)利用图b配制一定浓度的NaCl溶液
(4)利用图c配制一定物质的量浓度的NaNO3溶液
(5)用容量瓶配制溶液时,若加水超过刻度线,立即用滴管吸出多余液体
(6)配制溶液定容时,仰视视容量瓶刻度会使溶液浓度偏低
(7)配制溶液的定容操作可以用图d表示
A. ⑵⑸ B. ⑴⑹ C. ⑴⑷⑹ D. ⑴⑶⑸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H+、Na+、Al3+、Ba2+、OH、HCO3、Cl七种离子中的两种可以形成了甲、乙、丙、丁四种化合物,它们之间可以发生如下转化关系(产物H2O未标出),下列说法不正确的是
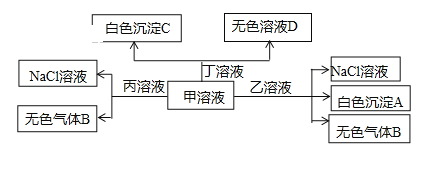
A. 白色沉淀A可能能溶解在溶液D中
B. 在甲中滴加丁可能发生反应:HCO3 + Ba2+ + OH == BaCO3 ↓ + H2O
C. 溶液丙与I、NO3、SO42 可以大量共存
D. 溶液乙一定是AlCl3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是()
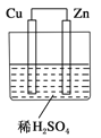
①Cu为负极,Zn为正极
②Cu极上有气泡产生,发生还原反应
③SO42-向Cu极移动
④若有0.5mol电子流经导线,则可产生0.25mol气体
⑤电子的流向是:Cu→Zn
⑥正极反应式:Cu+2e-==Cu2+,发生氧化反应
A. ①②③B. ②④C. ②③④D. ③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质性质与用途对应关系正确的是
性质 | 用途 | |
A | 硅酸钠化学性质稳定 | 制备木材防火剂 |
B | 硅酸溶胶具有 吸附水分的能力 | 硅作半导体的材料 |
C | 二氧化硅硬度大、熔点高 | 氢氟酸在玻璃上刻花纹 |
D | 焦炭具有可燃性 | 焦炭还原二氧化硅 冶炼粗硅 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图A~D四种物质均含有同一种元素,A可以是单质也可以是气态氢化物,D是该元素最高价氧化物对应的水化物,则A、B、C、D中共同含有的元素可能是
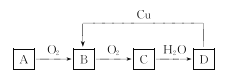
A. 氯 B. 铁 C. 碳 D. 氮
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com