
| 选项 | 叙述I | 叙述II |
| A | Mg有还原性 | 电解MgCl2饱和溶液可制备Mg |
| B | AgCl难溶于酸 | 用盐酸和AgNO3溶液检验Cl- |
| C | Ba(OH)2易溶于水 | 可配制1.0mol?L-1的Ba(OH)2溶液 |
| D | NH4Cl为强酸弱碱盐 | 用加热法除去NaCl中的NH4Cl |
| A. | A | B. | B | C. | C | D. | D |
分析 A.电解MgCl2饱和溶液生成氢氧化镁;
B.用盐酸引入氯离子;
C.Ba(OH)2易溶于水,可配制碱溶液;
D.NH4Cl不稳定,加热分解.
解答 解:A.电解MgCl2饱和溶液生成氢氧化镁,叙述II不合理,故A错误;
B.用盐酸引入氯离子,干扰氯离子的检验,叙述II不合理,故B错误;
C.Ba(OH)2易溶于水,可配制碱溶液,则可配制1.0mol?L-1的Ba(OH)2溶液,故C正确;
D.NH4Cl不稳定,加热分解,用加热法除去NaCl中的NH4Cl,叙述均合理,二者不具有因果关系,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,涉及电解、离子检验、溶液配制、混合物分离提纯等,把握物质的性质、反应原理为解答的关键,侧重分析与实验能力的考查,综合性较强,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 在0.1mol/LNaHCO3溶液中:c(Na+)>c(HCO3-)>C(CO32-)>c(H2CO3) | |
| B. | 在0.1mol/LNa2CO3溶液中:c(OH-)-c(H+)=c(HC03-)+c(H2CO3) | |
| C. | 向0.2mol/LNaHCO3溶液中加入等体积0.1mol/LNaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | 常温下,CH3COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1mol/L]:c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
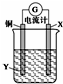
| A. | X可以是银或石墨 | B. | 电子从铜电极经外电路流向X电极 | ||
| C. | Y是硫酸铜溶液 | D. | X极上的电极反应式为Ag++e-═Ag |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学性质较活泼的金属为负极 | B. | 在正极上发生氧化反应 | ||
| C. | 在外电路,电子流出的极为正极 | D. | 是由电能转化为化学能的装置 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 金属锡的冶炼常用焦炭作还原剂:SnO2(s)+2C(s)═Sn(s)+2CO(g),反应过程中能量的变化如图所示.下列有关该反应的△H、△S的说法中正确的是( )
金属锡的冶炼常用焦炭作还原剂:SnO2(s)+2C(s)═Sn(s)+2CO(g),反应过程中能量的变化如图所示.下列有关该反应的△H、△S的说法中正确的是( )| A. | △H<0△S<0 | B. | △H>0△S<0 | C. | △H<0△S>0 | D. | △H>0△S>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
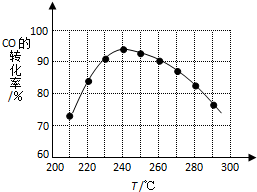 二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用.工业上以CO和H2为原料生产CH3OCH3的新工艺主要发生三个反应:
二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用.工业上以CO和H2为原料生产CH3OCH3的新工艺主要发生三个反应:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
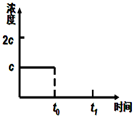 请你利用所学反应原理知识解决下列问题:
请你利用所学反应原理知识解决下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
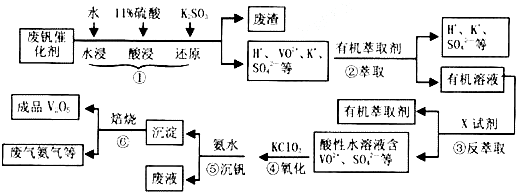
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率/% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com