
【题目】室温下,将1mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为ΔH1,将1mol的CuSO4(s)溶于水会使溶液温度升高,热效应为ΔH2;CuSO4·5H2O受热分解的化学方程式为:CuSO4·5H2O(s)![]() CuSO4(s) +5H2O(l),热效应为ΔH3。则下列判断正确的是( )
CuSO4(s) +5H2O(l),热效应为ΔH3。则下列判断正确的是( )
A. ΔH2>ΔH3 B. ΔH1>ΔH3
C. ΔH2+ΔH3=ΔH1 D. ΔH1+ΔH2=ΔH3
【答案】C
【解析】
CuSO4·5H2O(s)溶于水时温度降低,为吸热过程,可知△H1>0,反应式可写为:CuSO4·5H2O(s)= CuSO4(aq)+5H2O(l)(1);CuSO4(s)溶于水时温度升高,为放热过程,可知△H2<0,反应式可写为:CuSO4(s)= CuSO4(aq)(2);(1)-(2)可以得到CuSO4·5H2O(s)═CuSO4(s)+5H2O(l),根据盖斯定律有△H3=△H1-△H2,再结合△H1>0和△H2<0,则△H3>△H1>0,据此分析可得结论。
A.根据上述分析可知,△H2<0而△H3>0,所以△H3>△H2,故A错误;
B.根据上述分析可知,△H3=△H1-△H2,再结合△H1>0和△H2<0,则△H3>△H1,故B错误;
C.根据盖斯定律有△H3=△H1-△H2,即△H1=△H2+△H3,故C正确;
D.根据上述分析可知,△H1>0和△H2<0,则△H3>△H1>0,所以△H1+△H2<△H3,故D错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】小明化验单上“葡萄糖”一项结果为4.94×10-3mol·L-1。这里的“4.94×10-3mol·L-1”表示葡萄糖的( )
A.体积B.物质的量
C.摩尔质量D.物质的量浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:X为具有浓郁香味、不易溶于水的油状液体,食醋中约含有3%~5%的D,其转化关系如下图所示。
请回答:

(1)X的结构简式是__________________。
(2)A→B的化学方程式是____________________________________________。
(3)X+H2O→A+D的化学方程式是____________________________________________。
(4)下列说法不正确的是________。
A A+D→X的反应属于加成反应
B A与金属钠反应比水与金属钠反应要剧烈得多
C 除去X中少量D杂质可用饱和Na2CO3溶液
D 等物质的量的A、B、D完全燃烧消耗O2的量依次减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ:下列各项分别与哪个影响化学反应速率因素的关系最为密切?
(1)夏天的食品易变霉,在冬天不易发生该现象_____;
(2)同浓度不同体积的盐酸中放入同样大小的锌块和镁块,产生气体有快有慢_____;
(3)MnO2加入双氧水中放出气泡更快_____.
Ⅱ:在一定温度下,4L密闭容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如图:
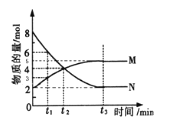
(1)比较t2时刻,正逆反应速率大小V正______V逆.(填“>”、“=”、“<”)
(2)若t2=2min,计算反应开始至t2时刻用M的浓度变化表示的平均反应速率为:_____.
(3)t3时刻化学反应达到平衡,反应物的转化率为_____.
(4)如果升高温度,则V逆_____(填增大、减小或不变).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将0.1 mol/LNaOH溶液分别滴加到0.1 mol/LHA溶液和HB溶液中,两混合溶液中离子浓度与pH的变化关系如图所示,回答下列问题:
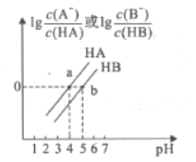
(1)请计算出Ka(HA) =_____,Ka(HB)_____ Ka(HA) (填“大于' “等于”或“小于”)。
(2)等浓度的HA和HB溶液,若要向其中之一加水让二者pH值相等,应该向_____中加水。
(3)若分别向等浓度等体积的HA和HB溶液中加入NaOH固体让二溶液都呈中性,则 ______需要的NaOH多。
(4)a点溶液中,水电离出的c(H+)=_______。b点溶液中,c(B-)____ c(Na+)(填“大于”、“等于”或“小于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知原子序数,可能推断原子的
①质子数 ②中子数 ③质量数 ④核电荷数 ⑤核外电子数
⑥原子结构示意图 ⑦元素在周期表中的位置
A. ①②③④⑥ B. ①④⑤⑥⑦
C. ②③④⑤⑦ D. ③④⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中,能表示反应X(g)+2Y(g)![]() 2Z(g)一定达到化学平衡状态的是( )
2Z(g)一定达到化学平衡状态的是( )
① X、Y、Z的物质的量之比为1:2:2 ② X、Y、Z的浓度不再发生变化
③ X、Y、Z的浓度相等时 ④ 单位时间内消耗nmolX,同时生成2nmolZ
⑤ 2υ正(X)=υ逆(Y) ⑥ 容器中的压强不再发生变化
⑦ 密闭容器内气体的密度不再变化 ⑧ 密闭容器内气体的平均相对分子质量不再变化
A. ③⑤⑥⑦ B. ①③④⑦
C. ②④⑧ D. ②⑤⑥⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置进行下列实验,能得出相应实验结论是( )
选项 | ① | ② | ③ | 实验结论 |
|
A | 稀硫酸 | Na2S | CuSO4溶液 | H2S酸性强于H2SO4 | |
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
C | 稀盐酸 | 亚硫酸钠 | 硝酸钡溶液 | 二氧化硫与可溶性钡盐均可生成白色沉淀 | |
D | 浓硝酸 | 碳酸钠 | 硅酸钠溶液 | 酸性:硝酸>碳酸>硅酸 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在如图所示的装置中进行中和反 应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃用品是________;
(2)用相同浓度和体积的醋酸代替稀盐酸溶液进行实验,求得的中和热数值________(填“偏 大”、“偏小”或“无影响”);
(3)实验中改用60 mL 0.50 mol/L 盐酸跟50 mL 0.55 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”),所求中和热________(填“相等”或“不相等”),简述理由________________________________________________________。
(Ⅱ).某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HNO3浓度为1.00 mol/L、2.00 mol/L,大理石有细颗粒和粗颗粒两种规格,实验温度为25℃、35℃,每次实验HNO3的用量为25.00 mL,大理石用量为10.00 g。
(4)请完成以下实验设计表,并在实验目的一栏中填空:
实验编号 | 温度(℃) | 大理石规格 | HNO3浓度(mol/L) | 实验目的 |
① | 25 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究浓度对反应速率的影响;(Ⅱ)实验①和③探究温度对反应速率的影响;(Ⅲ)实验①和④探究e_______对反应速率的影响 |
② | 25 | 粗颗粒 | a______ | |
③ | b_______ | 粗颗粒 | 2.00 | |
④ | c________ | 细颗粒 | d______ |
(5)实验①中CO2质量随时间变化的关系见下图。计算实验①中70 s~90 s范围内用HNO3表示的平均反应速率________(忽略溶液体积变化,不需要写出计算过程)。在O~70、70~90、90~200各相同的时间段里,反应速率最大的时间段是________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com